Article du mois
Publié le 01 mai 2022Lecture 3 min
Baricitinib dans la pelade, enfin les résultats des essais de phase III
François CHASSET, service de dermatologie et d’allergologie, hôpital Tenon, Paris
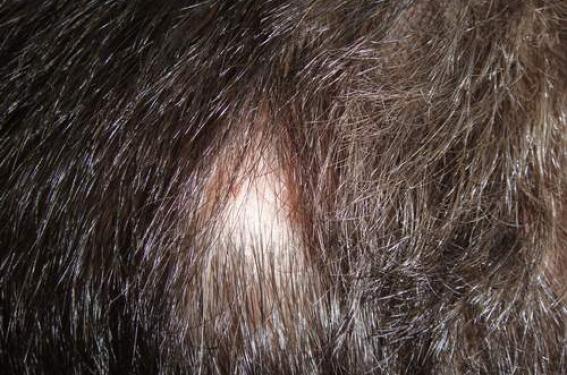
La pelade, alopecia areata est une maladie multifactorielle associant une forte prédisposition génétique et des anomalies du système immunitaire avec une composante auto-immune probable. L’incidence annuelle est estimée à 17 cas pour 100 000 personnes avec un risque cumulé au cours de la vie d’au moins un épisode estimé à 1,7 %. En dehors de la forme en plaque, il existe la forme totale (alopecia totalis) qui correspond à la perte de tous les cheveux et la forme universelle (alopecia universalis) qui correspond à la perte de tous les poils du corps.
L'évolution de la maladie est imprévisible avec globalement deux tiers des patients qui guérissent spontanément ou sous traitement entre 6 et 24 mois, et un tiers de patients qui présentent des formes résistantes. Les traitements classiques associent les dermocorticoïdes locaux très forts ou les injections intradermiques. En cas de formes résistantes, les bolus de solumedrol en association ou non avec le méthotrexate ont montré des résultats intéressants. Il existe néanmoins encore d’importants besoins thérapeutiques dans cette pathologie. Depuis quelques années, les inhibiteurs de JAK oraux ou topiques ont montré des résultats prometteurs dans la pelade dans des essais de phase II.
Dans cette étude, les auteurs rapportent les résultats de deux essais de phase III du baricitinib contre placebo. Il s’agissait de deux essais de phase III BRAVE- AA1 trial et BRAVE-AA2 trial, qui ont eu lieu dans 169 centres (10 pays) entre mars 2019 et mai 2020. Les patients inclus avaient un diagnostic de pelade Severity of Alopecia Tool (SALT) > 50, une durée d’évolution entre 6 mois et 8 ans. Ils étaient randomisés 3 : 2 : 2 pour recevoir 4 mg, 2 mg de baricitinib ou un placebo. Le minoxidil local ou per os ou la finastéride étaient autorisés à dose stable. Le critère de jugement principal était l’obtention d’un score SALT ≤ 20 à la semaine 36. Les deux essais ont inclus 654 et 546 patients respectivement. Il s’agissait d’environ 60 % de femmes dans chaque essai, d’un âge moyen de 36-39 ans selon les essais et les groupes. Il s’agissait d’une population caucasienne en grande majorité (seulement 8 % de patients d’origine africaine). L’épisode de pelade durait en moyenne depuis environ 4 ans, et plus de 90 % avaient eu un échec de dermocorticoïdes, ou corticoïdes intra-lésionnels ou oraux antérieurement.
À la semaine 36, le pourcentage de patients avec un score SALT ≤ 20 était de 38,8 % dans le groupe baricitinib 4 mg, 22,8 % dans le groupe 2 mg et 6,2 % dans le groupe placebo dans l’essai BRAVE-AA1. Dans l’essai BRAVE-AA2 les résultats étaient 35,9 %, 19,4 % et 3,3 % respectivement. Dans les deux essais, il existait une nette supériorité des deux doses par rapport au placebo p < 0,001 pour les deux doses. Le baricitinib était supérieur au placebo dans de nombreux critères secondaires en particulier la repousse des paupières et des sourcils. Concernant les effets indésirables, la prévalence des effets indésirables totaux était globalement similaire entre le placebo et les doses de baricitinib. La prévalence d’effets indésirables sévères était de 2,1 % dans le groupe 4 mg, 2,2 % dans le groupe 2 mg et 1,6 % dans le groupe placebo dans l’essai BRAVE-AA1 (résultats similaires pour le 2). Il n’y avait pas plus de zonas dans les groupes baricitinib avec une prévalence de 0,7 %. Deux cas de pneumonies sévères, et deux cas de pyélonéphrites ont été notés avec le baricitinib (toutes doses et cumulant les essais) contre zéro dans le groupe placebo. Il n’y a eu aucun effet indésirable thrombo-embolique ou de MICI. Il y a eu un cas d’infarctus du myocarde dans l’essai BRAVE-AA1 chez un patient avec facteur de risque cardivasculaire. Des cas d’acné étaient notés plus fréquemment dans le groupe baricitinib, de même que des augmentations des CPK et des anomalies du bilan lipidique.
Au total, le baricitinib démontre aux doses 2 mg, et surtout 4 mg, une nette supériorité à 36 semaines dans le traitement de la pelade par rapport au placebo. Il n’y a pas eu d’émergence de signal de pharmacovigilance avec un profil de tolérance qui semble même peut-être meilleur dans cette population de sujets majoritairement jeunes par rapport à d’autres indications.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :