Publié le 08 déc 2023Lecture 15 min
Rougeole - Un virus qui fait encore rougir en 2023
Stéphanie ABOU-MRAD, Paris
La sémiologie est une étape clé nécessaire et importante dans tout raisonnement médical diagnostic. Plus particulièrement, l’évaluation dermatologique clinique détaillée et minutieuse permet d’identifier diverses pathologies à forte expression cutanée, telles que les viroses, projetant souvent le spécialiste en première ligne.
VIRUS A RISQUE ÉPIDÉMIQUE
Ces dernières années, l’attention scientifique a été essentiellement focalisée sur le Sars-CoV-2, virus brutalement émergent ayant causé des dégâts inestimables sur le plan humain, médical et socio-économique. Ce germe a volé la vedette à de nombreux autres virus qui, pour autant, sont toujours en libre circulation.
Une panoplie de virus émergents sont en permanence surveillés par l’Organisation mondiale de la santé (OMS). Celle qui a récemment fait sa place parmi les maladies au suivi prioritaire est le Monkey pox, zoonose causée par le virus de la variole du singe (virus Mpox). Parmi les autres virus particulièrement menaçants, citons les virus zoonotiques Nipah, Ebola et Marburg, ainsi que les arboviroses zika, chikungunya et dengue(1).
Ces maladies émergentes risquent d’augmenter à l’avenir pour différentes raisons telles que la déforestation provoquant un contact de l’être humain plus proximal avec certains animaux, la modification de la répartition géographique de certaines espèces due aux changements climatiques, la hausse des flux de personnes par l’amélioration des transport en commun, etc.(1). Cependant, les virus émergents ne sont pas les seuls à inquiéter la communauté médicale. Certains virus virulents, supposément éradiqués ou potentiellement éradicables par la protection vaccinale obligatoire, font sporadiquement leur retour dans la population française métropolitaine.
PRÉMICES DE LA VACCINATION
Un exemple de succès d’éradication complète grâce à la vaccination est la variole humaine « smallpox » dans les années 1980(1), après au moins 3 000 ans de maladie et une catastrophe humanitaire au XXe siècle ayant entraîné 300 millions de décès. Ce virus est à l’origine de la mise au point d’un procédé précurseur de la vaccination : la variolisation. Ce concept d’immunisation croisée pensé par le médecin britannique Edward Jenner vers 1796 consistait à inoculer un virus moins létal pour l’humain, la vaccine « cow pox », à des personnes saines, dans l’optique de les protéger de la variole humaine. Jenner avait constaté que les personnes ayant contracté la vaccine étaient mieux protégées contre la variole. La vaccine se manifestait par des pustules, source de l’inoculum expérimental(2).
Méthode artisanale
Cependant, la théorie d’immunisation préventive avait déjà été constatée dès le Xe siècle par des scientifiques perses, et les prémisses de l’inoculation de la variole, assez artisanales et périlleuses, dateraient du XVIe siècle en Chine. L’inoculation consistait à inhaler des croûtes de pustules séchées réduites en poudre. Le concept se serait propagé par la Route de la soie pour gagner la Turquie puis l’Angleterre(3).
Il existait même une méthode de « variolisation naturelle » qui revenait à mettre en contact des sujets sains avec des individus ayant une forme bénigne de variole(3). Une variante à cette technique décrite en Europe du Nord et en France au XVIIe siècle(4) a vu le jour dans les années 1950 aux États-Unis : la pox party ou la fête de la varicelle. Plus surprenant, cette pratique sociale aurait augmenté lors de la pandémie de grippe A (H1N1) afin d’encourager l’immunisation naturelle(5). Selon le responsable de santé de l’état de Washington, des covid parties auraient également été organisées.
Rougeole en crescendo
Mais ces derniers temps, c’est le virus de la rougeole qui fait son retour dans le rang des alertes épidémiologiques, alarmant les autorités sanitaires et encourageant un renforcement de sa surveillance.
UNE COUVERTURE VACCINALE INSUFFISANTE
La rougeole est l’une des maladies les plus contagieuses et reste potentiellement éradicable par la vaccination(6). Avant l’avènement de l’immunisation en 1963, des épidémies étaient observées tous les 2 à 3 ans et étaient responsables d’environ 2,6 millions de décès par an. L’OMS estime que, entre 2000 et 2016, la vaccination a permis de prévenir au niveau mondial environ 20,4 millions de décès, ce qui en fait l’un des meilleurs investissements dans le domaine de la santé publique. En 2022, toujours à l’échelle mondiale, 74 % des enfants avaient reçu au moins une dose et 83 % avaient reçu les deux doses avant leur un an(7).
En France, la couverture vaccinale ROR (Rougeole-Oreillons- Rubéole) à deux doses (M12 puis M16-M18) est obligatoire pour tous les nourrissons nés à partir du 1er janvier 2018. Deux doses sont nécessaires, car la première ne garantit pas une immunisation chez tous les enfants(7). Malgré cette décision, l’objectif d’une couverture à 95 % à 2 ans n’est pas encore atteint, et une catégorie de la population reste à risque, notamment les adolescents et les jeunes adultes(8). Depuis 2008, une réémergence préoccupante de la maladie est observée, principalement due à une insuffisance de la couverture vaccinale(9). Cette insuffisance s’est encore plus creusée avec l’arrivée de la pandémie à Sars-CoV-2 qui a provoqué le relâchement et le recul de la surveillance épidémiologique du virus de la rougeole (VR)(10). Le dernier exemple en date est un cluster en septembre 2023 en Ardèche(11) : 11 cas ont été signalés, quasiment tous des élèves d’un même collège. À l’heure actuelle, aucun pays n’est à l’abri de ce virus(7).
UN POINT HISTORIQUE
Retour aux archives étymologiques
La première description de la rougeole est réalisée au Xe siècle par le savant perse Rhazès. Cette pathologie est désignée au Moyen Âge par le terme latin morbilli, dérivant du terme morbus évoquant « une petite maladie ». À cette époque, ce terme catégorise plusieurs autres maladies éruptives, dont la scarlatine, la lèpre, la variole, etc.(12).
Quelques siècles plus tard, au XVIIe siècle la rougeole est officiellement nommée « measles » par l’anglais Sydenham. Cette appellation vient de l’anglais médiéval « mesles » et du latin « misella », lui-même diminutif de « miser » (misère)(12).
Quant au mot « rougeole », l’évolution étymologique est moins claire que son équivalent anglais. Plusieurs appellations auraient existé telles que « rougeule » (XVe siècle) et « rougeolle » (XVIe siècle), probablement influencées par le terme « vérole ». Les personnes infectées au XIXe siècle se voyaient attribuer le qualificatif de « rougeoleux » ou « morbilleux »(13).
Néanmoins, il est important de ne pas confondre le terme anglais « rubeola » synonyme de « measles », avec son homonyme français « rubéole » causé par le rubivirus.
« Première maladie »
L’appellation « première maladie » trouve son origine vers la fin du XIXe siècle, lorsqu’une liste internationale d’exanthèmes infantiles a été établie. La rougeole était la première à y être citée(14). Elle figure parmi les 7 maladies infantiles les plus répandues dans le monde avec la varicelle, les oreillons, la rubéole, la coqueluche, les maladies diarrhéiques et la pneumonie d’étiologie virale ou bactérienne(15).
Jusqu’à ce jour, le VR cause entre 100 000 et 130 000 décès par an dans le monde, essentiellement des enfants de moins de 5 ans on ou mal vaccinés(7,16).
DISSECTION DU VIRUS
Il est supposé que l’ancêtre du VR est la peste bovine, virus qui se serait adapté à l’espèce humaine, devenant un agent pathogène d’une toute nouvelle maladie. En s’adaptant à l’homme, sans transition nécessaire par l’espèce bovine, ce virus aurait perdu son caractère(17) zoonotique. La peste bovine, quant à elle, a complètement été éradiquée en 2011.
Le VR, du groupe V selon Baltimore, appartient au genre Morbillivirus de la famille de Paramyxoviridae. Ce genre inclut la rougeole « measles », la peste bovine « rinderpest » et la mala-ie de Carré « distemper »(18). Les Paramyxoviridae ont un pouvoir pathogène essentiellement à tropisme respiratoire et neurologique(18).
Le VR est un virus enveloppé, à capside hélicoïdale(19) (coque protéique protégeant l’acide nucléique), à ARN (se répliquant donc dans le cytoplasme de l’hôte et non dans le noyau tel que le virus à ADN), monocaténaire (monobrin), et à polarité négative(20). Cette dernière caractéristique implique que le génome viral ne peut être directement utilisé par le ribosome cellulaire de l’hôte infecté, et le virus à ARN doit importer dans son virion quelques copies de l’ARN polymérase pour initier le cycle de réplication virale dans la cellule infectée(21). Son diamètre est compris entre 150 et 350 nm(22).
De façon très schématique, le virus a plusieurs protéines clés à disposition qui assurent sa survie. Celles qui lui permettent de s’immiscer dans la cellule infectée sont les protéines F et H. La protéine F est une protéine de fusion enchâssée dans sa membrane lipidique. La protéine H est une hémagglutinine qui permet au virus de se fixer aux récepteurs de la cellule hôte, notamment le CD150 et la nectine-4(22).
Le point d’entrée dans la cellule hôte se fait par le CD150, également impliqué dans la dissémination systémique. Ce récepteur est exprimé par certaines cellules immunitaires telles que les macrophages, les cellules dendritiques et les lymphocytes. Après contamination par voie respiratoire, la dissémination virale vers d’autres tissus est véhiculée par les lymphocytes, et constitue la phase de virémie. La nectine-4 est une protéine jonctionnelle des membranes basales épithéliales et permet une dissémination locale du VR depuis la cellule hôte vers les cellules voisines(23).
Une dissémination menaçante
Cet agent pathogène a un pouvoir contagieux très puissant, pouvant aller jusqu’à 90 % chez les personnes non immunisées(24). Une personne infectée peut donc transmettre la maladie jusqu’à 9 contacts proches non immunisés sur 10(7). Le R0 = 12 à 18. Ce virus a un réservoir strictement humain.
Les principales sources de transmission sont les sécrétions bronchiques et celles des voies aériennes supérieures, la salive et les larmes(25,26). Le principal mode de transmission est le contact direct via des gouttelettes projetées par une personne infectée à l’occasion d’une toux, d’un éternuement ou simplement de la parole, qui se déposent directement sur les muqueuses de la personne contaminée(20,27). Le virus peut persister sous forme de particules virales dans un espace clos jusqu’à 1 ou 2 heures après aérosolisation(20). Sont moins fréquentes les transmissions par inhalation de ces particules ou par contact indirect avec des surfaces inertes contaminées(20). Le germe peut survivre jusqu’à 2 heures après contamination de la surface inerte(25).
Fort heureusement, ce virus a une survie réduite par certaines inactivations physiques telles que les fortes chaleurs entre 30 et 56 °C pendant 30 minutes, les rayons UV(20,28) et les désinfectants tels que l’éthanol à 70 %, l’hypochlorite de sodium 1 %, la povidone iodée et le formaldéhyde(20,25). Par ailleurs, le principe de désinfection par rayons UV-C a été mis en pratique dans les années 1930 aux États-Unis, et la technique améliorée depuis est encore utilisée à ce jour dans les structures hospitalières et médicales(29).
Un virus amadoué
Le VR a un effet cytopathogène et entraîne la fusion des cellules infectées avec des cellules saines voisines. Ainsi un syncytium est créé (cellules géantes multinucléés) pouvant contenir une centaine de noyaux. S’ensuit une mort par apoptose de ces cellules.
Plus étonnant, il a été observé plusieurs cas de régression de lymphome dans les années 1970 après infection par le VR. Cela a suscité beaucoup d’intérêt chez les scientifiques et l’espoir de la découverte d’une nouvelle ligne thérapeutique en oncologie par thérapie virale(22).
À l’heure actuelle, des études sont en cours pour la mise au point d’un virus «oncolytique » artificiel se basant sur le génome viral de la rougeole(30).
L’ÉBULLITION DES SYMPTÔMES
L’infection au VR se manifeste différemment selon la phase virale. La transmission se fait dans la majorité écrasante des cas par transmission aérienne directe.
La phase d’incubation
La période silencieuse d’incubation dure 7 à 18 jours(7), pour une médiane de 12 jours(24,31). Elle correspond à l’intervalle entre la contamination par le VR et les premiers symptômes de la maladie. Durant cette phase, le virus est présent dans le système respiratoire, se multiplie et commence sa dissémination via sa virémie primaire.
La phase prééruptive dite « d’invasion »
Les premiers symptômes cliniques de la phase prééruptive se manifestent par une fièvre pouvant brutalement atteindre 40 °C, des signes généraux tels qu’une asthénie et une anorexie, une rhino-conjonctivite communément appelée «catarrhe oculo-conjonctivo-nasal » et une toux sèche(24,32,33). Cette phase dure 4 à 7 jours(7).
Le signe de Köplik
Le fameux signe quasi pathognomonique de Köplik semble apparaître très précisément vers la 36e heure de la phase d’invasion précédant la phase éruptive classiquement de 24 à 48 heures. Il s’agit de papules de 2 à 3 mm de diamètre, semblables à des « grains de sable », au centre blanchâtre ou bleuté, sur fond érythémateux. Souvent observé dans le sillon gingivo-jugal, en regard des molaires, cet énanthème peut atteindre toute la surface de la muqueuse buccale(32,34,35). La couleur blanchâtre des lésions serait liée à la destruction cellulaire de l’épithélium glandulaire, et la couleur bleuâtre découlerait d’une dilatation des veines de la sous-muqueuse des conduits glandulaires. Ce signe est présent dans 60 à 70 % des cas, et a donc une haute importance dans l’établissement du diagnostic de la rougeole pour un confinement précoce(35). Cet énanthème régresse 2 à 3 jours après son apparition, parallèlement à la survenue de la phase éruptive(33,35).
La phase éruptive
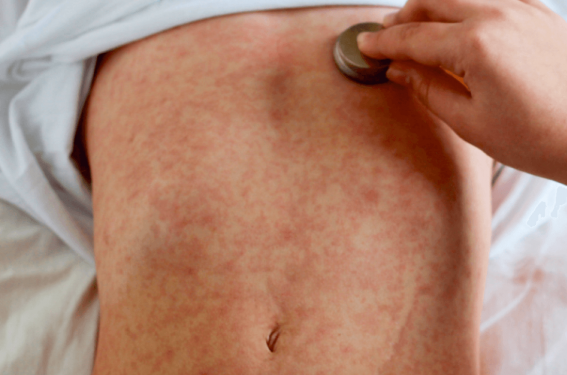
La phase éruptive est la plus parlante. Lors du début de l’éruption, les signes prodromiques sont à leur pic(36). L’exanthème caractéristique de la rougeole débute sur le visage, à la lisière du cuir chevelu et en zone rétro-auriculaire pour ensuite s’étendre progressivement durant 3 jours(7), de façon descendante, à la nuque, au tronc puis aux membres. C’est un érythème maculopapuleux, non prurigineux, non vésiculeux, puncti-forme, constitué d’éléments de petite taille(37), confluent mais avec intervalle de peau saine(38). Initialement, l’exanthème disparaît à la vitropression et perd cette caractéristique vers J3-J4(39). Les patients sont contagieux 4 jours avant cette phase éruptive et jusqu’à 4 jours après(7,39). Le pic de la contagiosité est cependant en phase prodromique(37). L’éruption qui passe du rouge au rouge cuivré régresse en moyenne en 5 ou 6 jours(7) en suivant le même ordre topographique que celui de l’apparition des lésions. Une desquamation est attendue en fin d’éruption(33). Les zones palmoplantaires sont généralement épargnées(33,39).
ZOOM PHYSIOPATHOLOGIQUE SUR LA PHASE ÉRUPTIVE
Comme précédemment abordé, lors de la virémie, les lymphocytes ainsi que les macrophages CD150+ infectés sont distribués vers différents tissus par la circulation sanguine. Sur le plan cutané, ces cellules rejoignent le derme par les capillaires, et plus particulièrement les zones folliculaires et sébacées qui sont richement vascularisées. S’ensuit localement une interaction contagieuse avec les cellules immunes CD150+ et les cellules épithéliales nectine-4+. La propagation du VR se fait du derme vers l’épiderme. Les kératinocytes basaux infectés facilitent à leur tour une contamination latérale et apicale. Plus le kératinocyte mature et a une progression apicale, plus il exprime la nectine-4+(23). Chez les immunodéprimés, notamment les séropositifs au VIH, cette manifestation cutanée peut être retardée, voire quasi absente, compte tenu de l’altération des lymphocytes(36).
De la suspicion clinique au diagnostic biologique
La technique de référence en ville pour la confirmation diagnostique est la sérologie sur prélèvement sanguin. Les IgM sont positifs dès l’éruption et sont détectables jusqu’à 60 jours après. Un seul prélèvement positif est suffisant pour porter le diagnostic. En cas de prélèvement négatif lors des trois premiers jours de l’éruption, un contrôle biologique doit être réalisé par un second prélèvement. Les IgG sont détectables quasiment en même temps que les IgM. Le diagnostic est retenu sur la séroconversion ou une élévation d’au moins 4 fois du titre de IgG sur 2 prélèvements espacés de 10 à 20 jours(7,16).
Il est important de noter qu’une détection d’IgM sur prélèvement salivaire constitue une technique diagnostique alternative, gratuite pour le patient. Des kits de prélèvement salivaire peuvent être demandés à la Direction des affaires sanitaires et sociales (DASS) à l’occasion du signalement d’un cas. Ces kits pourraient surtout être utilisés pour la confirmation d’éventuels cas ultérieurs(39).
D’autres tests existent, notamment le test d’amplification des acides nucléiques (RT-PCR) permettant de détecter l’ARN du VR. Un prélèvement oropharyngé est réalisé par écouvillonnage, idéalement dans les premiers jours de l’éruption, sauf pour l’immunodéprimé chez lequel la fenêtre de détection est plus longue(40). Actuellement, la RT-PCR rougeole n’est pas inscrite à la nomenclature des actes de biologie médicale (NABM) et n’est pas prise en charge par l’Assurance-maladie lors des prélèvements dans les laboratoires de ville.
Réflexe MADO et prophylaxie
La rougeole fait partie des 34 maladies à déclaration obligatoire (MADO). Dès son diagnostic, un signalement nominatif sans délai doit être transmis à l’ARS afin d’initier une mise en place de mesures préventives autour du cas par les autorités sanitaires. Une notification détaillée via un formulaire spécifique doit également être transmise par voie électronique ou postale à l’ARS pour faciliter la surveillance épidémiologique. Des précautions complémentaires type air doivent être instaurées en milieu hospitalier, avec utilisation d’un masque FFP2(41).
Il existe deux méthodes préventives chez les sujets contacts :
– une mise à jour du calendrier vaccinal est nécessaire chez les cas contacts, avec une vaccination à envisager selon le sujet dans les 72 heures suivant le contage présumé(42) ;
– des immunoglobulines (IG) polyvalentes postexposition peuvent aussi être envisagées chez des sujets contacts.
Elles sont efficaces si l’administration intraveineuse se fait dans les 6 jours suivant le contage. Les indications retenues par la CSHPF (conseil supérieur d’hygiène publique de France) sont :
– la femme enceinte non vaccinée et sans antécédents de rougeole ;
– le sujet immunodéprimé ;
– les enfants de moins de 6 mois dont la mère a une rougeole ;
– les enfants âgés de 6 à 11 mois non vaccinés dans les 72 heures postexposition.
Après immunoprophylaxie, une vaccination avec le vaccin triv lent est recommandée aux âges prévus par le calendrier vaccinal après un respect d’un délai d’au moins 3 mois.
Une rougeur à fort risque de complications
La rougeole a été la première maladie infectieuse contagieuse reconnue comme immunosupressive, bien avant la découverte de son pathogène, vers le XIXe siècle(43).
Cette fonction immunosuppressive rend le VR particulièrement dangereux et augmente la susceptibilité aux infections secondaires bactériennes et virales. Dans la littérature, il est rapporté que l’état d’immunodépression induit peut persister de quelques semaines jusqu’à 3 ans postinfection(36,39).
Les complications aiguës sont fréquentes, pouvant aller jusqu’à 40 % des cas, surtout chez les personnes à risque : les immunodéprimés, les femmes enceintes, les dénutris, les nourrissons et les adultes de plus de 20 ans(39,41). L’otite moyenne aiguë avec risque de surdité et la diarrhée aiguë avec risque de déshydratation sont fréquentes notamment chez les enfants(39,41,45). Les formes adultes de rougeole sont volontiers responsables d’une altération de l’état général avec hépatite et thrombopénie(37).
Les deux complications les plus sévères sont la pneumopathie et la méningo-encéphalite.
La complication pulmonaire est soit induite par le VR avec une atteinte interstitielle pouvant mener à un syndrome de détresse respiratoire aiguë, soit secondaire à une surinfection virale, notamment à l’adénovirus et à l’HSV, ou à une surinfection bactérienne par Staphylococcus aureus, Streptococcus pneumoniae ou Haemophilus influenzae(45).
La complication neurologique peut se manifester sous 3 formes :
– l’encéphalite aiguë postéruptive qui se manifeste à J8 de l’infection avec un risque élevée de séquelles et de démyélinisation secondaire ;
– l’encéphalite subaiguë à inclusions survenant chez l’immunodéprimé plusieurs mois après l’infection ;
– la panencéphalite subaiguë sclérosante observée dans les mois voire les années qui suivent l’infection(36,47). Cette maladie neurodégénérative entraîne une détérioration cognitive, des myoclonies massives bilatérales e›t des convulsions(47).
PLACE DE LA VITAMINOTHÉRAPIE
La carence spécifique en vitamine A peut aggraver toute forme de complication(48). Il est par conséquent recommandé d’administrer deux doses de vitamine A per os aux enfants et adultes atteints de la rougeole. Ce traitement simple permet de diminuer les décès et contribue à la prévention des lésions oculaires et la cécité(7).
RISQUE FŒTO-MATERNEL NON NÉGLIGEABLE
Le VR passe la barrière placentaire mais n’est pas tératogène. Il peut cependant entraîner une fausse couche ou un accouchement prématuré. Une rougeole congénitale peut être causée par une contamination en fin de grossesse ou dans les 10 jours post-partum, avec un risque de décès majeur et de pancéphalite sclérosante subaiguë précoce pour l’enfant(37,39). En cas de vaccination ou d’immunisation chez la mère, le nourrisson est protégé par les anticorps maternels transplacentaires au moins jusqu’à ses 6 à 9 mois(40).
Figure 1. Frise chronologique clinique, de l’incubation à l’éruption.
Figure 1. Réponse sérologique postéruption.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :