Infectiologie
Publié le 08 jan 2024Lecture 11 min
Œdème inflammatoire retardé à l’acide hyaluronique
Stéphanie ABOU-MRAD, Paris
Le recours à l’acide hyaluronique est en plein essor, avec une recrudescence mondiale de son utilisation de plus de 60 % en 2021 en comparaison à 2017(1). Les interventions injectables avec ce produit sont estimées à environ 5 800 000 en 2021, soit 30 % des procédures non chirurgicales à visée esthétique toutes catégories confondues. Les États-Unis en sont le premier pays consommateur, suivi du Brésil et de l’Allemagne(1). La France fait discrètement son entrée dans la démocratisation de la médecine esthétique avec 420 000 actes non invasifs réalisés par an(2). Le visage est une structure complexe et dynamique, formée de traits spécifi ques et uniques, essentiels à l’expression d’émotions et à la communication non verbale. L’acide hyaluronique gagne en popularité pour le maintien du rajeunissement de cette région corporelle. Une nouvelle entité, encore mal connue, a fait son apparition dans le rang des effets indésirables liés à l’acide hyaluronique.
VIGNETTE CLINIQUE
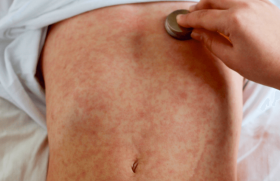
Une patiente de 64 ans consulte pour un premier épisode d’œdème du visage, localisé en zone périorbitaire, jugal, et labial. Elle n’avait jamais eu d’urticaire superficielle ni d’œdème et ne relatait pas de dermatose préexistante.
La patiente avait pour seuls antécédents personnels une hypothyroïdie sous Levothyrox© et une hypertension artérielle essentielle traitée par bisoprolol. Par ailleurs, elle n’avait jamais eu de traitement antérieur par inhibiteur d’enzyme de conversion (IEC). Aucun antécédent familial n’était connu, notamment pas d’angioœdème ni de maladie auto-immune.
Cette éruption avait été précédée d’une angine, dans un contexte de contage viral. Un état fébrile rapidement résolutif avait été également constaté, sans autres signes associés. À l’époque, le bilan diagnostic de débrouillage par Streptotest et dépistage Covid n’avait pas été réalisé.
DIAGNOSTIC CLINIQUE ET HYPOTHÈSES
À ce stade, l’hypothèse d’un angioœdème histaminique était évoquée. Une première ligne thérapeutique par anti-histaminiques per os à dose optimale était inefficace. La deuxième ligne thérapeutique par corticothérapie orale 1 mg/kg prise pendant 10 jours avait permis une amélioration partielle des symptômes, sans toutefois un retour complet à l’état normal.
La patiente a consulté en dermatoallergologie à plus de 6 se maines de la survenue de cet œdème. Elle décrivait une sensation constante de tension prurigineuse mais non douloureuse. Cliniquement, l’œdème n’avait pas de signe d’inflammation, mais il était légèrement induré à la palpation. L’impact esthétique était important et entraînait une nette diminution de la qualité de vie.
Il existait une autre hypothèse plus plausible, moins connue mais en vogue depuis quelques années : la réaction inflammatoire retardée aux agents de comblement dermique, induite par un trigger infectieux. En l’occurrence, l’éruption était apparue dans les suites d’une angine, dans un contexte de forte recrudescence d’infection par le Sars-CoV-2 et de séjour à l’étranger.
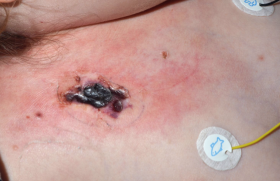
En répondant à un interrogatoire minutieux, la patiente confirmait avoir eu recours aux injections d’acide hyaluronique sur les zones concernées. Les dernières injections dataient d’il y a plus de 6 mois et avaient été réalisées à l’étranger.
Les explorations sanguines étaient normales avec un bilan thyroïdien (TSH, anti-TPO, anti-TRG), tryptase, NFS, bilan rénal et hépatique, bilan auto-immun (AAN, anti-ADN), quantiferon, LDH et bilan immunologique (EPP, anti-C1 estérase, dosages du C1 inhibiteur pondéral et fonctionnel, C4 et C3, ECA).
Ce bilan immunologique d’exploration du complément normal était en défaveur d’un angioœdème bradykinique sans l’exclure formellement. Les autres hypothèses théoriques à évoquer pour raisonner sur un «œdème du visage », telles que l’eczéma de contact ou encore la cellulite de la face et les étiologies thromboemboliques (syndrome cave supérieur/œdème en pèlerine, thrombophlébite cérébrale) n’étaient pas cliniquement compatibles. Les hypothèses néoplasiques et de granulomatoses n’avaient pas été écartées par biopsie cutanée en raison du refus de la patiente ; les imageries du massif facial (IRM du massif facial et un panoramique dentaire) avaient été demandées de principe et infirmaient ces diagnostics.
Dans cette hypothèse de réaction inflammatoire retardée aux agents de comblement dermique, après concertation et bibliographie, un traitement d’épreuve par lisinopril, un IEC, a été débuté à la dose de 5 mg initialement puis augmenté à 10 mg quelques jours après, avec une bonne réponse thérapeutique.
À FLEUR DE PEAU
La peau est le revêtement de notre âme, et le visage est le miroir de notre état d’esprit. Cette pensée a une part de vérité, car le système cutané est indéniablement le prolongement du système nerveux et de l’humeur. Il est en régénération permanente avec une maturation des kératinocytes de la couche cornée à l’épiderme qui se fait au terme d’une migration de 3 semaines(1). Mais la peau est également en proie à une sénescence inévitable liée à l’âge qui laisse incontestablement la marque jugée ingrate de son passage. Ce phénomène mène à une insuffisance cutanée chronique expliquée par l’altération de plusieurs mécanismes que le monde scientifique essaie de constamment combattre.
Afin de ralentir le vieillissement de la peau et notamment celui du visage, et comme l’eau de jouvence n’est pas près d’être découverte, différents produits injectables ont été pensés afin de pallier la dégradation de certaines molécules nécessaires à la stabilité et au fonctionnement cutané.
MÉCANISME DE VIEILLISSEMENT DE LA PEAU
Deux mécanismes sont spécifiquement impliqués dans le processus de vieillissement. L’altération de la viscoélasticité cutanée Deux molécules principales sont présentes dans la matrice extracellulaire de la peau et sont des glycosaminoglycanes (GAG, de longues chaînes complexes de saccharides) : l’acide hyaluronique non sulfaté (AH) comblant l’espace entre les fibres et le dermatane-sulfate étroitement combiné au collagène(2).
L’AH détermine la viscosité de la matrice et le collagène son élasticité. Avec l’âge sont observées une baisse de l’AH et une fracture du collagène menant à la perte de la viscoélasticité.
Défauts de la signalisation acide hyaluronique/CD44
L’AH est loin d’être une molécule inactive. Il est non seulement un produit d’intérêt dans la viscoélasticité cutanée mais joue également un rôle important de signalisation intracellulaire par sa liaison avec le CD44(3), qui est son principal récepteur transmembranaire.
Toutes les fonctionnalités de ce dernier n’ont pas encore été clairement déterminées. Ce qui a cependant été mis en évidence est que la signalisation intracellulaire est un pivot fondamental dans la prolifération kératinocytaire en réponse aux stimuli extérieurs ainsi que dans l’homéostasie locale de l’AH. Au cours du vieillissement, cette signalisation diminue et un ralentissement du renouvellement cutané en résulte. Sans grande surprise, cette voie de signalisation est par ailleurs au cœur d’études oncologiques étant donné son implication confirmée dans certaines proliférations tumorales(4).
Il existe deux catégories de produits de comblement injectables(5) : les permanents et les biodégradables. La première catégorie, non dégradable, consiste en produits synthétiques ou alloplastiques, tels que la silicone et les produits acrylates ; la seconde concerne les produits biodégradables, tels que l’AH et le collagène.
ZOOM SUR L’ACIDE HYALURONIQUE
Comme précédemment mentionné, l’AH est une chaîne linéaire de polysaccharides non ramifiée et non protéinée, constituée d’une répétition de deux disaccharides, l’acide Dglucuronique et le N-acétyl-Dglucosamine (figure 1). Comme il a la même structure moléculaire dans tous les organismes, son risque d’immunogénicité est considéré comme très faible(6). Il est retrouvé majoritairement jusqu’à 50 % dans la matrice extracellulaire du derme mais également dans celle du tissu conjonctif et de l’humeur vitrée. Sa structure lui donne un caractère très hydrophile et lui permet d’absorber jusqu’à plus de 1 000 fois son poids en eau(7). Cette molécule est présente chez tous les vertébrés(8).
Figure 1. Composition de l’acide hyaluronique.
À l’état naturel, l’AH est rapidement dégradé par l’hyaluronidase, et sa demi-vie est assez courte, environ 24 heures. Ce qui ne serait évidemment pas satisfaisant en termes de rendement esthétique. Afin de contrer ce phénomène, l’AH destiné à des fins esthétiques est modifié par « cross linking », un processus de réticulation qui permet des liaisons covalentes irréversibles entre plusieurs chaînes linéaires de la molécule. Plus le produit est réticulé, plus sa viscosité augmente et lui permet une longévité allant de 2 à 5 ans(9). Le cross linker le plus utilisé est le BDDE (1,4-butanediol diglycidyl ether)(10).
Deux types de fillers à usage différent existent après cross linking : les monophasiques et les biphasiques. Les seconds sont moins réticulés que les premiers, et sont donc plus facilement dégradables, avec un effet moins rémanent.
Comment produire une quantité satisfaisante d’AH pouvant répondre à la demande massive du marché, notamment celui de la cosmétologie ?
Le processus le plus rentable à l’échelle industrielle est actuellement celui du recours à la mise en culture des bactéries du genre Streptococcus et plus spécifiquement l’espèce Streptococcus zooepidemicus. L’AH synthétisé dans leurs capsules extracellulaires est similaire à l’AH produit dans les tissus mammifères(11). Ces germes sont bien évidemment éliminés à l’issue d’un procédé complexe de purification (figure 2). Cette technique a supplanté la première voie d’obtention de l’AH de moins en moins utilisée, produite à partir de tissu animal, tel que les crêtes de coq et les cordons ombilicaux.
Figure 2. Processus simplifié d’un gel d’acide hyaluronique (AH).
Le revers de la médaille
L’AH très convoité n’est pas exempt d’effets indésirables. Plusieurs facteurs peuvent les favoriser tels qu’une mauvaise technique d’injection, des soins dentaires, un épisode infectieux bactérien ou viral ou une vaccination(9). Il a par ailleurs été démontré que les haplotypes HLA-B* 08 et DR1*03 augmentent le risque d’événements indésirables tardifs après injection de produits de comblement dermique(12).
Ces dernières années, l’une des complications émergentes, favorisée par l’arrivée inattendue de la pandémie du Sars-CoV-2, est la réaction inflammatoire retardée à l’AH, induite par ce germe (delayed inflammatory reactions [DIR] to hyaluronic acid). Ce virus mondialement connu pour ces complications systémiques, notamment pulmonaires, l’est nettement moins sur le plan esthétique. Le Sars- CoV-2 aurait donc l’audace de s’inviter jusque dans nos rides. Ladite réaction déjà observée avant l’ère du Sars-CoV-2 est désormais en augmentation. De façon générale, les DIR se manifestent par un œdème, un érythème ou une dépigmentation, et une induration tissulaire ou des nodules qui peuvent être douloureux. Ces symptômes sont localisés aux zones d’injection d’AH. Leur délai d’apparition peut varier de 2 à 4 semaines post-injection jusqu’à plus d’un an, voire plusieurs années(13). Leur incidence est estimée entre 0,3 et 4,25 %, ce qui est relativement faible mais non négligeable(14). La longévité grandissante de l’AH permise par le processus de stabilisation du cross linking pourrait également expliquer l’observation d’une recrudescence de cas.
Interaction du virus et de la peau
Il est scientifiquement admis que le Sars-CoV-2 déjoue le système rénine-angiotensinealdostérone (SRAA), principal acteur dans la régulation de la pression vasculaire, en le tournant à son avantage. Il se lie au récepteur ACE2 par sa protéine Spike, afin de pénétrer la cellule (figure 3), induisant un déséquilibre dans le système SRAA et renforçant négativement les effets de l’angiotensine II qui deviennent délétères(15). L’ACE est l’acronyme anglais de « angiotensin converting enzyme » et son équivalent français est l’ECA « enzyme de conversion de l’angiotensine ».
Figure 3. Interaction entre le virus Sars-CoV-2 et le récepteur transmembranaire ACE2.
L’ACE2 est exprimé dans quasiment tous les tissus du corps humain, y compris cutanés(9). Sa présence ubiquitaire dans notre organisme pourrait expliquer le polymorphisme clinique des atteintes du Sars-CoV-2.
Le récepteur ACE2 joue un rôle essentiel dans la métabolisation des angiotensines I et II. Les métabolites obtenus participent à la vasodilatation et ont une action anti-inflammatoire. En monopolisant ce récepteur transmembranaire, la protéine Spike du Sars-CoV-2 bloque cette métabolisation et la balance du système vasculaire est déséquilibrée (figure 4.).
Figure 4. Métabolisation de l’angiotensine II altérée par le virus Sars-CoV-2.
L’angiotensine II n’étant plus correctement métabolisée, son rôle pro-inflammatoire et sa vasoconstriction induite augmentent conséquemment(16). Comme déjà évoqué, l’ACE2 est présent dans les tissus cutanés, plus particulièrement à la surface des fibroblastes dermiques, des kératinocytes mais aussi dans l’endothélium du derme moyen et profond, et dans la microvascularisation sous-cutanée. Les produits de comblement à l’AH sont générateurs d’une angiogenèse de la zone injectée, ce qui augmente davantage la concentration d’ACE2 localement(9,17). Ce phénomène pourrait expliquer le ciblage par le virus de ces zones cutanées ayant été comblées à l’AH et renfermant plus d’ACE2, rendant ces tissus à risque(9).
D’autre part, l’hypothèse d’une fragmentation de l’AH en un produit de poids moléculaire plus bas lui conférerait une action pro-inflammatoire par opposition à son action initiale anti-inflammatoire. La dégradation du produit serait initiée par la production de radicaux libres après infection virale. Ces radicaux sont de puissants inducteurs du métabolisme de l’AH. Plus elle est de bas poids moléculaire, plus son immunogénicité serait élevée. Le Sars-CoV-2 aurait ce pouvoir interactif avec cette molécule, conduisant indirectement à sa dépolymérisation(17).
Il est important également de citer le rôle du CD44, principal ligand de l’AH et présent à la surface des lymphocytes. Ce récepteur est augmenté lors d’une infection virale, ce qui renforce la signalisation cellulaire et active le recrutement des lymphocytes in situ(18,19).
Plus brièvement, les DIR après injection d’AH induites par Sars-CoV-2 ont une physiopathologie complexe, comprenant une régulation négative de l’ACE2, une dégradation de l’AH et une augmentation du CD44. Ces actions mènent toutes à un environnement proinflammatoire (figure 5).
Figure 5. Hypothèses pro-inflammatoires des DIR in situ induites par le Sars-CoV-2.
Retour au calme
Les DIR induites par trigger infectieux sont généralement réversibles. La complexité de la prise en charge est exacerbée par le profil de la patientèle ayant initialement recherché un effet esthétique et subissant le résultat inverse, ainsi que par la résolution lente des symptômes pouvant aller de plusieurs jours à plusieurs semaines voire mois. Jusqu’à présent, il n’y a pas de protocole de prise en charge bien établi. Les différentes lignes thérapeutiques utilisées actuellement sont : la corticothérapie orale par méthylprednisolone 1 mg/kg pendant 8 à 14 jours(9), la doxycycline 100 mg/jour pendant 1 à 2 semaines jusqu’à 4 semaines(13), et l’hyaluronidase pouvant nécessiter des injections répétées in situ(20). Cette enzyme est utilisée comme antidote, capable de dissoudre l’AH. L’hyaluronidase est reconstituée soit dans du sérum physiologique NaCL 0,9 %, soit dans de l’anesthésie locale telle que la Lidocaïne 1 à 2 % afin de réduire la douleur lors de l’injection(21). Son dosage est globalement de 5 à 15 unités. Pour les zones périorbitales, la dose est de 1,5 à 3 unités(22). Une nouvelle ligne thérapeutique est également proposée depuis la pandémie à Sars-CoV-2 : une faible dose d’inhibiteur d’enzyme de conversion pouvant rétablir un équilibre au sein du système SRAA dé joué par le virus(9,20,23). En résulterait une inhibition de l’ACE1 et in fine une limitation de l’augmentation de l’angiotensine II (figure 6).
Figure 6. Rééquilibre par IEC.
L’IEC à faible dose essentiellement proposé est le lisinopril 5 mg pour une durée de 3 à 5 jours, ou 48 heures après le début d’une résolution des symptômes. Un doublement de la dose peut être réalisé en cas d’inefficacité(20). Ce traitement serait plus bénéfique en cas de DIR post-vaccination Covid. Il est par ailleurs recommandé de prévoir une fenêtre de 4 à 8 semaines entre les injections d’AH et la vaccination(20).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :