Dermatite atopique, Eczéma
Publié le 01 nov 2015Lecture 17 min
Microbiome cutané et dermatite atopique : un puzzle complexe
O. DEREURE, CHRU de Montpellier
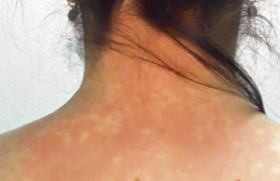
La dermatite atopique est une affection cutanée inflammatoire fréquente dont l’incidence semble en hausse continue et qui peut actuellement toucher jusqu’à 25 % des enfants et 7 % des adultes dans les pays industrialisés. Sa physiopathologie reste mal connue dans ses détails, même si sa compréhension globale a significativement progressé assez rapidement depuis plusieurs années. Ses mécanismes sont manifestement basés sur des facteurs dits intrinsèques et extrinsèques. Elle comporte notamment l’exposition à des allergènes « extrinsèques » de l’environnement (pneumallergènes et trophallergènes) qui interagissent avec un terrain particulier, « intrinsèque », de nature génétique.
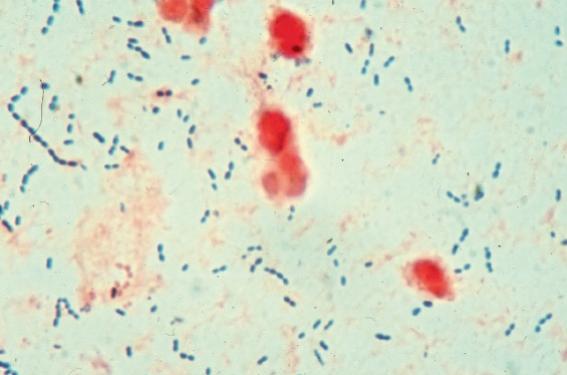
Ce terrain perturbe tant l’immunité innée, en particulier l’efficacité de la barrière cutanée (en raison notamment de mutations délétères de la filaggrine qui empêchent l’édification d’une barrière cutanée efficace), que l’immunité adaptative avec un déséquilibre au profit de la voie dépendant des lymphocytes TH2 ; ce qui aboutit à une hyperproduction d’IgE et à la production de certaines cytokines telles IL4, IL5 (et donc à une hyperéosinophilie) et TSLP. Diverses théories ont été proposées au fil du temps pour expliquer, en dehors du terrain génétique, ce déséquilibre immunitaire et cette orientation prioritaire manifestement délétère de la réponse immune adaptative vers la voie TH2. Citons notamment une théorie « hygiéniste » qui postule qu’une diminution des stimuli infectieux habituels issus de l’environnement (qui sont plutôt la cible d’une réponse par les lymphocytes de type TH1 sécrétant l’IL2 et de l’interféron gamma) en raison de conditions sanitaires hypersécurisées dans les pays les plus « avancés » sur le plan socioéconomique, pourrait favoriser la prédominance, presque « passive », de l’immunité dépendant de la voie TH2. Par ailleurs, la distinction entre dermatite atopique (DA) intrinsèque (ou « endogène ») et extrinsèque (ou « exogène ») en fonction de l’importance relative des facteurs intrinsèques (génétiques) et extrinsèques (influence de l’environnement) reste en partie d’actualité, même s’il faut probablement se garder d’une modélisation par trop simpliste qui n’a pas forcément de conséquences vraiment significatives en pratique. Dans ce schéma général, qui se précise peu à peu en restant complexe, est venu se glisser récemment un troisième partenaire, intermédiaire (à tous les sens du terme) entre les facteurs intrinsèques et extrinsèques, le microbiome cutané qui interagit de façon très importante avec l’immunité cutanée innée et adaptative. On commence à entrevoir le rôle majeur de ces interactions complexes et à double sens entre ces différents acteurs au cours des poussées de la maladie, mais peut-être aussi dans la physiopathologie globale de la DA. Le microbiome cutané Le terme de microbiome ou microbiote désigne l’ensemble des micro-organismes présents dans un tissu, qu’ils soient commensaux et symbiotiques (le plus souvent), pathogènes facultatifs ou obligatoires, et ce, quelle que soit leur nature : bactéries (bactériome), virus (virome), parasites et espèces fungiques (mycome). Les deux principaux microbiomes humains concernent le tube digestif et le revêtement cutané, et représentent une telle diversité génomique que le microbiome est parfois appelé « second génome ». Le microbiome notamment commensal est en équilibre avec l’immunité innée qui constitue une première ligne de défense rapide mais peu spécifique contre les agents pathogènes. L’immunité innée est liée essentiellement aux macrophages et aux kératinocytes et fonctionne en assurant une barrière chimique et physique contre les agents agressifs et en reconnaissant des « profils » ou motifs moléculaires simples, considérés comme dangereux, communs à diverses classes d’agents pathogènes ou fruits de la dégradation de structures cellulaires selon le type de récepteurs en cause (Toll Like Receptors [TLR] pour les agents externes, notamment microorganismes ou Nod Like Receptors [NLR] pour les éléments dangereux d’origine interne). La reconnaissance de ces profils (patterns) a priori dangereux donne ensuite lieu à une phase de réponse qui passe par l’activation d’une série de relais intracellulaires groupés au sein de l’inflammasome, puis par la sécrétion de molécules proinflammatoires généralistes (IL1, TNF alpha, etc.), l’activation des polynucléaires et des macrophages, et la production de peptides antimicrobiens (bêta-défensines, cathélicidines, prodermcidine, etc.). Le microbiome cutané fait partie intégrante de cette composante de l’immunité en empêchant l’occupation des niches écologiques par des espèces plus agressives et en assurant la production de peptides antimicrobiens d’origine bactérienne. L’immunité adaptative assure, quant à elle, une défense plus lente mais plus efficace, car plus spécifique, contre les agents pathogènes ; elle est liée aux lymphocytes T et B et fait preuve de « mémoire » contrairement à l’immunité innée. Les interactions entre ces trois éléments sont complexes et en cours de décryptage. En ce qui concerne le bactériome, les techniques microbiologiques, historiquement basées sur les cultures, ont beaucoup évolué et reposent désormais sur la biologie moléculaire utilisant l’amplification de l’ADN codant pour l’ARN de la sous-unité 16S des ribosomes bactériens, structure commune à toutes les bactéries et qui assure en principe une amplification exhaustive de toutes les espèces présentes même peu représentées, ce qui n’est pas le cas pour les cultures. Appliquées à la peau, ces techniques ont permis de mettre en évidence une grande diversité de germes cutanés, avec des répartitions différentes des espèces selon trois principaux types de zones (sèches vs humides vs sébacées),mais une distribution assez similaire entre les individus sur une même zone. Divers facteurs externes et internes influent sur cette bactériosphère cutanée, notamment les conditions climatiques, la température corporelle, l’âge, le sexe, l’existence d’une affection inflammatoire, la profession, les habitudes de vie (hygiène, emploi d’émollients, etc.). Par ailleurs, ce bactériome n’est pas seulement présent dans les follicules pileux et à la surface de l’épiderme, mais aussi plus en profondeur dans le derme et l’hypoderme, mettant fin à l’illusion de la « préservation » de ces zones. Les virus sont égalementreprésentés, mais leur analyse est plus délicate car il n’y pas de culture simple possible ni de séquence consensus analogue de l'ARNr bactérien. Il faut donc utiliser les techniques plus lourdes mais très puissantes de la métagénomique fonctionnelle utilisant le séquençage à haut débit, et des méthodes de soustraction des séquences bactériennes et de l’hôte. Le virome cutané semble également très diversifié (HPV, polyomavirus notamment MCPyV, bactériophages, etc.), mais sa connaissance ainsi que la compréhension de son rôle éventuel restent très préliminaires. Les éléments symbiotiques ou commensaux du microbiome cutané échappent à l’activité de l’immunité innée mais contribuent probablement à son efficacité en maintenant un niveau minimal d’activation par une stimulation permanente, liée notamment au S. epidermidis, qui induit la production de peptides antimicrobiens par les kératinocytes après liaison aux TLR2, et stimule l’activité des macrophages et des polynucléaires neutrophiles, probablement par les propriétés chimiotactiques et pro-inflammatoires des peptides antimicrobiens qu’il produit directement. Par ailleurs, il limite l’activation indue et potentiellement dangereuse de l’immunité innée, par exemple après traumatisme cutané, en produisant de l’acide lipotéchoïque qui a une action inhibitrice sur les cellules inflammatoires. Dermatite atopique et microbiome cutané Les liens, au moins conceptuels, entre DA et microbiome cutané sont multiples et de différentes natures : – anomalies bien établies de la barrière cutanée, notamment par des mutations de la filaggrine facilitant, du moins théoriquement, la pénétration transépidermique des micro-organismes ; – fréquence et, dans certains cas, gravité particulière des surinfections cutanées bactériennes ET virales ; – « classique » présence importante de S. aureus sur la peau des atopiques, notamment lors des poussées inflammatoires de la maladie. L’exploration de ces liens bénéficie actuellement des progrès majeurs des techniques microbiologiques, en particulier de l’échantillonnage très précis autorisé par les techniques de biologie moléculaire, et de la meilleure compréhension du mode de fonctionnement et de l’importance de l’immunité innée cutanée et des relations microbiome/immunité innée/immunité adaptative, en particulier dans la modulation de l’inflammation cutanée. L’analyse des relations entre le microbiome cutané et notamment le bactériome, est pour l’instant, surtout descriptive et utilise les techniques de culture puis plus récemment moléculaire. • De très nombreuses études, convergentes, ont globalement établi l’existence, sur un plan statique, d’une colonisation chronique majoritaire et inhabituelle de la peau des patients atteints de DA par S. aureus, présent chez 90 % des patients, tant sur peau lésionnelle que non lésionnelle, y compris sur des zones où sa présence n’est pas habituelle à l’état résident sur peau normale. Les analyses récentes ont montré une augmentation du pourcentage des SARM dans cette population, parallèlement à ce qu’on observe chez les non-atopiques. Ces données statiques sont complétées par des données « dynamiques » également intéressantes, montrant une réduction importante de la diversité bactérienne au cours des poussées, notamment sur les zones « bastions », avec augmentation parallèle du pourcentage de S. aureus et S. epidermidis aux dépens des autres espèces cutanées commensales habituelles (Propionibacterium, Streptococcus, Corynebacterium…) dans le bactériome cutané de ces zones. • Cette augmentation parallèle des deux espèces de staphylocoques est étonnante et très particulière à la DA. Elle pourrait être liée : – soit à un mécanisme compensatoire, S. epidermidis venant contrôler la prolifération potentiellement dangereuse de S. aureus tant en établissant une compétition biologique vis-à-vis des nutriments disponibles et en produisant des peptides antimicrobiens, qu’en stimulant l’immunité innée anti-S. aureus, – soit à une authentique coprolifération pathologique des deux germes, S. epidermidis quittant son rôle commensal et « innocent » habituel pour stimuler de façon indue les phénomènes inflammatoires locaux, ou même pour devenir authentiquement pathogène et générer des surinfections. • Une rediversification bactérienne et une réduction relative du pourcentage de S. aureus et S. epidermidis au sein du bactériome cutané sont ensuite observées lors de la réduction des phénomènes inflammatoires locaux liés à la poussée par le traitement local, avec restauration de la diversité et de la répartition des espèces observées à l’état de base. Il est très intéressant de constater que cette réduction de diversité précède l’apparition des poussées cliniques ; sa réapparition précède sa disparition, ce qui ne permet toutefois pas d’établir sans ambiguïté que les modifications de flore précèdent l’apparition des phénomènes inflammatoires biologiques ou inversement, en raison du décalage temporel entre l’inflammation biologique et clinique. • Par ailleurs, on observe une sur-représentation de certaines espèces rares (Rothia) et ce, quel que soit l’état cutané. Même si une peau saine est donc manifestement caractérisée par une diversité bactérienne normale, il est impossible d’établir actuellement formellement que cette réduction de diversité est cause (par stimulation de l’immunité innée par une charge bactérienne anormale du moins par sa répartition et considérée comme dangereuse) ou au contraire conséquence (par augmentation de l’expression de molécules de surface par les kératinocytes sous l’effet des cytokines pro-inflammatoires, permettant une adhésion plus facile des bactéries, en particulier des différentes espèces de staphylocoques, à la surface cutanée) des poussées, et donc de décider quel est le phénomène initial qui peut d’ailleurs être variable. Il est, en revanche, possible, voire probable que, quel que soit ce dernier, un véritable cercle vicieux se mette en place, basé sur les liens réciproques entre immunité innée et bactériome cutané, impliquant une boucle d’amplification faisant intervenir modulation de l’adhésion bactérienne aux kératinocytes, réduction de la diversité bactérienne cutanée et phénomènes inflammatoires supplémentaires qui découlent de cette dernière, induits par la présence excessive d’espèces de type staphylocoques qui stimulent l’immunité innée. • Un concept innovant et potentiellement intéressant, notamment par ses implications thérapeutiques potentielles, a été introduit récemment dans l’analyse des liens microbiome cutané/DA : celui du biofilm bactérien. La notion de biofilm bactérien, agglomérat de bactéries associé à un feutrage de polysaccharides sous forme de microbilles plus ou moins coalescentes et peu accessibles aux anti-infectieux, n’est pas nouvelle en soi, mais a été appliquée récemment à la DA. Il semble en effet qu’un tel biofilm constitué de S. aureus soit présent dans les infundibulums des glandes eccrines chez les patients atteints de DA, y compris sur la peau en apparence normale, réalisant ainsi une véritable occlusion sudorale qui pourrait être à l’origine du classique prurit thermoinduit. Cette véritable « miliaire eccrine » infraclinique pourrait également être responsable d’une insensibilité relative des germes contenus dans le biofilm aux anti-infectieux systémiques, mais également d’une activation locale de l’immunité innée via l’activation des récepteurs TLR2, avec production de cytokines pro-inflammatoires notamment de TNF alpha et de médiateurs pruritogènes. • Le microbiome non bactérien a été nettement moins exploré dans la DA que le bactériome et aucun lien conceptuel précis n’a été vraiment établi avec la maladie et ses poussées. Toutefois, il est habituellement admis la présence d’une probable prédominance de certaines espèces de levures du genre Malassezia (M. globosa, sympodialis, etc.) dans les lésions inflammatoires chroniques de l’extrémité cervico-céphalique (classique head and neck dermatitis), ainsi qu’une surreprésentation de certaines levures d’autres espèces et une densité plus importante de demodex sur la peau inflammatoire et d’allure normale des atopiques, sans qu’on puisse vraiment préciser l’existence de liens avec les poussées et notamment une variation de charge et de répartition comme pour le bactériome. En ce qui concerne le virome, aucune étude spécifique n’a été menée et tout reste à découvrir mais la présence, là encore, de liens à double sens entre phénomènes inflammatoires et virome est tout à fait envisageable. L’étude de ces liens sera toutefois nettement plus difficile qu’avec les bactéries, nécessitant l’emploi des méthodes plus lourdes de métagénomique fonctionnelle appliquées aux différentes situations cliniques. Dermatite atopique, microbiome et immunité Le partenaire du microbiome cutané, l’immunité innée, ne fonctionne pas normalement dans la DA. Là encore, il est difficile de dire s’il s’agit de causes ou de conséquences des modifications du bactériome. Un cercle vicieux auto-aggravé est, là aussi, parfaitement envisageable. Globalement, l’immunité innée est moins efficace ou d’efficacité « déviée » dans la DA par divers mécanismes. Ces anomalies concernent tout d’abord l’efficacité des diverses barrières cutanées antibactériennes physiques et chimiques, en particulier de la couche cornée, en raison essentiellement des mutations de la filaggrine, mais aussi d’anomalies fonctionnelles et/ou structurales d’autres protéines importantes de l’enveloppe, en particulier des protéines de petite taille riches en proline (SPR). On peut également signaler la présence d’altérations fonctionnelles ou de mutations inactivatrices des récepteurs aux patterns bactériens de type TLR2, probablement à l’origine d’une sensibilité particulière aux bactéries (notamment justement à S. aureus), voire des altérations des NLR. Diverses anomalies des peptides antimicrobiens ont également été rapportées dans la DA, en particulier une réduction de la production des cathélicidines, défensines, dermcidine, peut-être en raison de l’action de cytokines dépendantes des lymphocytes TH-2 dépendantes, ou une production de base suffisante, voire supérieure à la normale, mais induction moins efficace en cas de prolifération bactérienne, notamment de staphylocoques. Ces anomalies participent également à l’altération de la barrière physique puisque les peptides antimicrobiens peuvent stimuler la formation de cette dernière. Les relations microbiome/immunité innée/immunité adaptative et leurs anomalies éventuelles sont particulièrement complexes dans la DA et loin d’avoir été totalement déchiffrées d’autant plus qu’elles varient probablement selon les patients, voire chez un même patient. Le déficit relatif en lymphocytes TH1 favorise la prolifération des bactéries, notamment des staphylocoques, tandis que le déséquilibre TH1/TH2 au profit des TH2 entraîne une hyperproduction d’IL-4 et IL-13, responsable d’une réduction des peptides antimicrobiens et d’une altération de la barrière physique. L’ensemble favorise la prolifération du S. aureus (ce qui peut léser la barrière cornée par la production d’enzymes) et l’induction d’une apoptose des kératinocytes par une toxine sécrétée par S. aureus. Il s’ensuit une hyperproduction d’IL-31 qui à son tour stimule les lymphocytes TH2 dans une boucle d’autopromotion et d'autoamplification de ces anomalies. Enfin, une troisième composante de l’immunité adaptative pourrait être dérégulée dans la DA, les lymphocytes TH17, ce qui pourrait entraîner un déficit en IL-17/IL-23 (… ou un excès dans les formes « intrinsèques » ?) à l’origine, là encore, d’anomalies des peptides antimicrobiens et de la barrière cornée. La production d’IgE spécifique des toxines de S. aureus, favorisée par le déséquilibre TH1/TH2, peut participer à l’activation des basophiles dont le rôle reste à déterminer, mais dont les enzymes peuvent également léser la barrière cornée. Implications thérapeutiques potentielles La restauration de l’équilibre et d’une diversité du bactériome cutané semble donc primordiale, mais les moyens d’y parvenir ne sont pas évidents : antibiothérapie séquentielle systémique ou topique (mais avec quels produits et selon quel schéma ?), lutte contre les biofilms, bains ou gel de Dakin dilué, exploitation des propriétés antibactériennes des UV, etc. Dans tous les cas, une réduction de la charge bactérienne est en effet obtenue, mais la recolonisation est rapide et l’influence sur le cours de la maladie n’est pas prouvée. De nouveaux concepts se sont alors fait jour pour tenter d’agir sur les anomalies du microbiome cutané et de l’immunité innée dans la DA : – restaurer l’activité probablement déficitaire des TLR par l’emploi d’agonistes locaux, – utilisation d’anticorps anti-IL-23 dans les formes « intrinsèques » où cette cytokine pourrait être en excès (essai thérapeutique en cours), – applications topiques de peptides antimicrobiens de synthèse (céragénines), – développement d’inhibiteurs des toxines de S. aureus, – emploi de textiles antibactériens… L’exploration du rôle des virus (bactériophages notamment) sera peut-être une piste prometteuse et probablement non restreinte à la DA. Ces innovations sont d’autant plus nécessaires que le niveau de preuve de l’impact des traitements antibactériens actuels sur le cours de la DA est jugé « moyen », selon la célèbre base de données Cochrane… Peut (et doit…) mieux faire ! Si le microbiome cutané a pour l’instant concentré la grande majorité de l’intérêt des chercheurs dans la DA, on ne peut passer sous silence l’importance controversée du microbiome digestif dans la DA et l’atopie en général, mais les données disponibles sont encore très (trop ?) disparates pour en tirer des conclusions pertinentes. On peut quand même citer la prédominance rapportée de certaines espèces bactériennes, la réduction (là encore)… ou l’augmentation de la diversité bactérienne (mais d’autres travaux ne retrouvent aucune anomalie bien particulière), tandis que les résultats des probiotiques oraux apparaissent très inconstants dans la DA, notamment en prévention des poussées.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :