Technique
Publié le 18 avr 2018Lecture 5 min
La microscopie confocale ex vivo en chirurgie dermatologique
Elisa CINOTTI(1,2), B. LABEILLE(2), P. RUBEGNI(1), F. CAMBAZARD(2), J.-L. PERROT(2) - 1. Hôpital S. Maria alle Scotte, CHU de Sienne, Italie ; 2. CHU de Saint-Étienne
La microscopie confocale ex vivo (MCEV) dédiée à la dermatologie est une technique récente d’imagerie qui permet d’effectuer un examen microscopique des échantillons chirurgicaux cutanés entiers sans besoin de congélation ni de fixation en formol. De plus, la MCEV ne modifie pas le tissu et n’empêche pas un examen histopathologique ultérieur. Elle permet un examen rapide de l’échantillon cutané directement dans la salle de chirurgie et elle représente ainsi une alternative au contrôle micrographique peropératoire des marges chirurgicales des tumeurs cutanées par examen microscopique standard sur coupes d’échantillon cryocongelé ou fixé en formol lors de la chirurgie de Mohs. À ce jour, la technique est en amélioration continue et trouve de nombreuses applications.
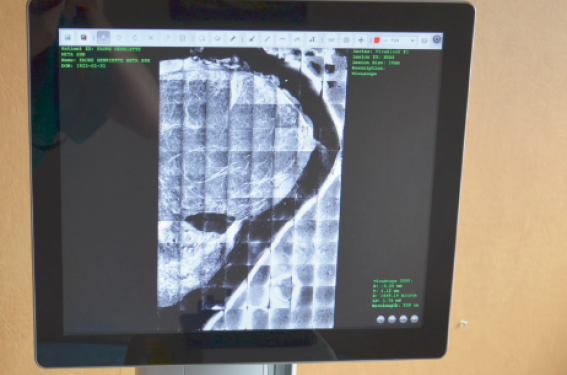
Un seul dispositif de microscopie confocale ex vivo est dans le commerce : VivaScope 2500®, Caliber, NewYork, États-Unis, distribué en Europe par MAVIG GmbH, Munich, Allemagne (figure 1). Il peut travailler en mode de réflectance (longueur d’onde du laser de 830 nm) ou en mode fluorescence (longueur d’onde du laser de 488 nm ou 658 nm) avec un agent fluorescent (acridine orange, bleu de méthylène, etc.). Il produit des images horizontales de l’échantillon, de 750 x 750 µm, qui sont assemblées automatiquement dans une image reconstruite en mosaïque jusqu’à une taille maximale de 20 x 20 mm. Le temps d’acquisition pour une seule image de 750 x 750 µm est de 0,68 secon des (2 min/cm2) pour la génération 3 de la machine. Selon les données du fabricant, les résolutions spatiales latérales et axiales sont respectivement de 1 µm et 3 µm.
Figure 1. Microscope confocal ex vivo VivaScope 2500®.
Images de MCEV
Comme la microscopie confocale in vivo, la machine saisit des images horizontales des différentes couches de la peau jusqu’à 250 µm.
• En mode réflectance, les images apparaissent en niveaux de gris avec des structures hyporeflétantes sombres (noir et gris foncé) et des structures hyperreflétantes claires (blanc et gris clair) avec un aspect identique à celui de la microscopie confocale par réflectance in vivo (figure 2).
• En mode fluorescence, les structures non fluorescentes sont sombres (noir et gris foncé) et les structures fluorescentes sont blanches. L’agent fluorescent le plus utilisé est l’acridine orange. En fluorescence par acridine orange, les noyaux des cellules sont marqués en blanc avec une augmentation du contraste des kératinocytes, des cellules tumorales et des fibroblastes par rapport au tissu autour (figure 3). En particulier, dans le cas du carcinome basocellulaire, les ilots du carcinome sont très facilement reconnaissables car ils apparaissent plus clairs (fluorescents) que le tissu autour, à cause de leur densité cellulaire importante (figure 4).
Figure 2. Aspect de la peau normale en microscopie confocale ex vivo en mode réflectance.
Accolade rouge : épiderme ; accolade jaune : derme ; étoile jaune : lobules adipeux.
Figure 3. Aspect de la peau normale en microscopie confocale ex vivo en mode fluorescence
(acridine orange). Accolade rouge : épiderme ; accolade jaune : derme ;
étoile jaune : lobules adipeux.
Figure 4. Aspect d’un carcinome basocellulaire superficiel en microscopie confocale ex vivo
en mode fluorescence (acridine orange) ; les nodules tumoraux (cercle bleu)
sont plus clairs que la peau autour, car très fluorescents.
Examen en MCEV dans la pratique
L’échantillon cutané est monté entre deux lames de verre pour l’aplatir, et de la silicone peut être utilisée pour unir de manière réversible les deux lames (figure 5). De plus, notre groupe a mis au point un aplatisseur du tissu qui peut être utilisé pour mieux aplatir l’échantillon(1). Aucune coloration n’est nécessaire en mode réflectance. En revanche, si l’examen est fait en mode fluorescence, la pièce chirurgicale entière est trempée dans une solution d’agent fluorescent pendant 30 secondes et rincée au sérum physiologique ou à l’acide acétique. La longueur d’onde du laser est choisie en fonction de l’agent fluorescent : 488 nm (par exemple pour acridine orange, l’agent fluorescent le plus utilisé en MCEV) ou 658 nm.
Figure 5. Doubles lames avec pièce chirurgicale au milieu fixées par de la silicone rose et disposées sur la platine du microscope.
Applications
La MCEV a démontré être une méthode diagnostique fiable avec une bonne correspondance histologique autant pour la peau normale que pathologique(2,3). Elle représente une alternative à l’examen en microscopie optique de sections congelées ou fixées en formol pour le contrôle peropératoire de marges chirurgicales des tumeurs cutanées lors de la chirurgie de Mohs. La plupart des études sur la MCEV ont été conduites sur l’analyse des marges chirurgicales du carcinome basocellulaire(2,4,5). Notre groupe a proposé aussi son utilisation dans le mélanome(6) et la maladie de Paget(7).
Notre groupe a également évalué son utilisation dans la pathologie non tumorale pour l’identification de l’herpès virus simplex(8) et le diagnostic des mycoses profondes(9). La MCEV trouve aussi sa place pour l’examen peropératoire des ongles(6,10) et des poils(11) et l’étude de la muqueuse orale, génitale et conjonctivale(12-14). Une application ultérieure est l’identification des produits de comblement dans la peau(15). De la dermatologie, la MCEV s’est étendue à d’autres disciplines qui peuvent nécessiter un examen extemporané des tumeurs, telles que les tumeurs cérébrales, mammaires et de la thyroïde(16,17).
MCEV pour de contrôle des marges chirurgicales des tumeurs
La pièce chirurgicale peut être examinée entière ou peut être coupée suivant le schéma de la « tarte de Tübingen »(18). Jusqu’à présent, l’analyse des marges chirurgicales a été réalisée plutôt en coupant la marge profonde et latérale (tarte de Tübingen) et en les analysant dans un plan vertical, perpendiculaire à la surface de la peau. Notre groupe a proposé une analyse dans un plan horizontal, parallèle à la surface de la peau (techni que « en face »), de façon à voir l’échantillon chirurgical tout entier avec ses marges sans devoir le couper (12). Une pièce cutanée jusqu’à 2 cm de dia mètre peut être examinée sur la totalité de sa surface et profondeur. Les pièces plus grosses doivent être déplacées manuellement sur la platine ou coupées en plusieurs fragments orientés. Plusieurs études ont été menées pour évaluer la valeur de la MCEV en mode fluorescence pour l’évaluation des marges chirurgicales des carcinomes
basocellulaires(4,19,20). Une étude menée par Bennassar et ses collègues sur 84 carcinomes a démontré une sensibilité et une spécificité globales de détection de carcinome basocellulaire résiduel de 88 % et 99 %, respectivement(5,21). De plus, la MCEV a réduit de deux tiers le temps investi par rapport à l’analyse des sections congelées(21).
En conclusion, la MCEV est une nouvelle technique d’imagerie qui permet d’analyser des échantillons cutanés entiers, jusqu’à 2 cm de diamètre, sans être coupés en sections fines. Elle permet un examen rapide du tissu qui peut être utile en peropératoire pour le contrôle des marges chirurgicales des tumeurs. Le carcinome basocellulaire a été le plus étudié, mais des nombreuses autres tumeurs sont en phase d’évaluation en MCEV ainsi que des pathologies non tumorales.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :




