Publié le 27 mar 2020Lecture 7 min
Dermatite atopique modérée à sévère, des évolutions, de la prévention au traitement
A. MORAND, Boulogne-Billancourt
Fréquente à tous les âges, la dermatite atopique a bénéficié de l’arrivée du dupilumab, première biothérapie, qui est aujourd’hui entrée dans le quotidien. Cet élargissement de l’arsenal thérapeutique modifie les stratégies existantes.
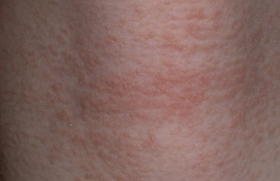
La dermatite atopique (DA) est une maladie fréquente à tout âge. Dans la cohorte anglaise Health improvment network, qui a inclus plus de 8 millions de personnes âgées de 0 à 99 ans, la prévalence de la DA était de 11,3 % entre 0 et 17 ans, de 3,8 % entre 18 et 74 ans et de 7,1 % après 75 ans(1). Selon l’âge de début de la DA et son évolution dans l’enfance, plusieurs phénotypes sont aujourd’hui distingués : le « early transient », qui apparaît avant l’âge de 2 ans avant de connaître une rémission, le « early persistent », qui lui débute aussi avant 2 ans, mais persiste dans le temps, le « late phenotype », où la DA débute après l’âge de 2 ans et le « never » ou « infrequent phenotype », désignant l’absence de DA(2). En cas de phénotype précoce, le risque d’allergie alimentaire et d’asthme est augmenté, ce qui fait de cette population pédiatrique une cible privilégiée du dépistage. Le phénotype clinique de la DA varie aussi en fonction de l’origine ethnique. Il est lié à des anomalies génétiques de la barrière cutanée, notamment de la filaggrine, et à un système immunitaire orienté vers les voies Th2, Th1et Th22 chez les sujets originaires d’Europe et d’Amérique du Nord. Il est plutôt psoriasiforme, avec une augmentation de l’expression de la voie Th17, chez les personnes d’origine asiatique. Dans d’autres régions, comme en Afrique du Sud, il n’y a pas d’anomalie de la barrière cutanée.
Pas de stratégie validée en prévention primaire
Il n’y a aujourd’hui pas de stratégie de prévention primaire de la DA qui soit validée et consensuelle. Les effets potentiels des émollients sur la qualité de la barrière cutanée et le blocage de la cascade de l’inflammation ont conduit à les évaluer dans ce contexte. Deux études publiées en 2014 avaient ainsi mis en évidence les bénéfices du recours précoce à des émollients, dès les premiers jours de vie, chez des nouveau-nés à risque : réduction de 50 % du risque de développer une DA à 6 mois et à 1 an. Mais ces résultats n’ont pas été confirmés par ceux de l’étude BEEP, présentés lors du dernier Congrès mondial de dermatologie(3). Dans cette étude bien plus vaste que les précédentes, puisqu’elle a inclus 1 395 nouveau-nés à risque, l’application quotidienne d’émollient sur l’ensemble du corps (sauf le scalp) commencée dans les 3 premières semaines de vie et poursuivie pendant un an n’a pas permis de réduire l’incidence de DA. Après 2 ans de suivi, l’incidence de la DA était en effet de 25 % dans le groupe émollient comparativement à 23 % dans le groupe contrôle. De plus, le recours précoce aux émollients était dans cette étude associé à une augmentation du risque d’allergie alimentaire IgE-médiée.
Une autre piste explorée est celle des probiotiques oraux, qui sont inefficaces en traitement curatif, mais pourraient être efficaces en prévention primaire, en particulier chez les enfants à risque. Selon plusieurs études, la diminution du risque relatif de DA varierait de 22 à 36 %. Les probiotiques sont d’ailleurs au menu des recommandations de 2015 de la WAO (World Allergy Organization), qui les préconise pour la prévention de la DA chez les enfants à risque, avec cependant un faible niveau de preuve. L’administration (mélange de souches) se fait au dernier trimestre de la grossesse et au cours des 6 premiers mois de vie via l’allaitement maternel ou les laits maternisés. En pratique, il est recommandé de manger sain et équilibré, en incluant des produit s fermentés et en évitant les laits gélifiés qui ne contiennent pas de probiotiques.
Efficacité confirmée pour le méthotrexate
Alors qu’il est autorisé et largement utilisé aux États-Unis, le méthotrexate n’a pas d’AMM en Europe, où il est cependant prescrit hors AMM. Il a une place dans les recommandations européennes de 2018, dans la DA sévère (SCORAD > 50) ou persistante, en association aux anti-inflammatoires(4). Une étude française publiée en 2017, qui avait comparé MTX et ciclosporine (5 mg/kg/j), avait conclu à la non-infériorité du MTX (25 mg par semaine) dans le traitement de la DA modérée à sévère de l’adulte(5). Ses effets étaient de survenue moins rapide qu’avec la ciclosporine, mais le profil de tolérance était meilleur. L’étude rétrospective nationale du GREAT (Groupe de recherche sur l’eczéma atopique), ayant inclus 272 patients adultes traités par MTX, n’a pas permis de définir le profil type du patient répondeur au MTX en fonction des antécédents et du profil clinique. Le taux de répondeurs était globalement de 74 % à 3 mois, de 88 % à 6 mois et de 93 % à 12 mois.
Avec un suivi moyen de 13,5 mois, le taux d’interruption de traitement était de 47 %, dû à des effets secondaires digestifs dans 22 % des cas, biologiques (notamment cytolyse) dans 14 % des cas, infectieux (10 %) ou neurologiques (asthénie, 7 %). Le MTX constitue ainsi une alternative thérapeutique efficace et fiable. Son utilisation hors AMM repose sur des données validées et une AMM post-commercialisation est attendue. En pratique, le bilan préthérapeutique est le même que celui préconisé dans le psoriasis, et la voie souscutanée doit être privilégiée, à la posologie initiale de 0,3 mg/kg/semaine.
La qualité de vie compte aussi
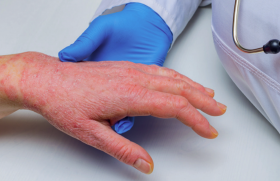
Pour l’éligibilité au traitement systémique, il faut désormais intégrer l’altération de la qualité de vie, attestée par le score DLQI. En 2019, la stratégie thérapeutique se fonde donc en premier lieu sur l’optimisation des traitements locaux (émollients, dermocorticoïdes et tacrolimus en topiques) et des mesures associées (éducation thérapeutique, lutte contre la corticophobie…). L’échec des traitements locaux, qui fait passer à un traitement systémique, ne répond pas à une définition consensuelle, mais peut être considéré comme la persistance d’un score élevé d’activité de la maladie et/ou de l’altération de la qualité de vie, malgré des traitements locaux et des mesures associées bien conduits. Au sein des traitements systémiques conventionnels : la photothérapie, qui est surtout utile pour passer un cap chez des patients dont la maladie régresse au soleil, la ciclosporine, qui bénéficie d’une AMM, et le MTX, hors AMM, mais avec des données solides publiées.
Changement de raisonnement avec le dupilumab
L’arrivée du dupilumab, première biothérapie indiquée dans la DA modérée à sévère de l’adulte en cas d’échec, d’intolérance ou de contre-indication à la ciclosporine, a changé la donne. Cet anti-IL-4 et IL-13 est disponible en officine de ville depuis mars 2019 et est utilisé dans le cadre d’une ATU chez les adolescents de 12 à 17 ans depuis octobre de la même année. La ciclosporine pourrait être désormais à considérer avant le dupilumab en schémas courts, à 5 mg/kg si possible, en cure unique ou en nombre limité. L’arrêt devrait être rapide en cas de problème de tolérance et le switch également rapide en cas de poussée après l’arrêt (pas de wash-out), en privilégiant un chevauchement de traitement.
Avant l’instauration du dupilumab, il est proposé de réaliser un bilan biologique, de vérifier le statut vaccinal et le désir de grossesse ou la contraception, de s’assurer de l’absence de parasitose en cas de séjour à risque ou de signes d’appel. Un avis ophtalmologique est demandé en cas d’antécédents et un avis pneumologique en cas d’asthme ou de suspicion d’asthme. Il s’agit d’un traitement d’exception, d’initiation hospitalière. Son efficacité doit être évaluée à 16 semaines, au moyen de score médecin et score patient, notamment l’IGA et le DLQI pour leur simplicité. Le traitement peut être si besoin optimisé en intensifiant le traitement local, en associant un traitement systémique.
Conjonctivites et effets paradoxaux
L’étude du GREAT en vraie vie a permis de mieux préciser l’efficacité et la tolérance du dupilumab et notamment de confirmer la survenue fréquente de conjonctivites (38,2 %), et d’hyperéosinophilie (56,5 %)(6). Il est donc recommandé d’informer les patients du risque de conjonctivite sous dupilumab et des signes de kérato-conjonctivite devant conduire à une consultation spécialisée en urgence. La prise en charge thérapeutique de la conjonctivite, de physiopathologie encore mal connue, doit se faire conjointement avec l’ophtalmologue. L’utilisation de tacrolimus à 0,1 % sur les paupières paraît intéressante.
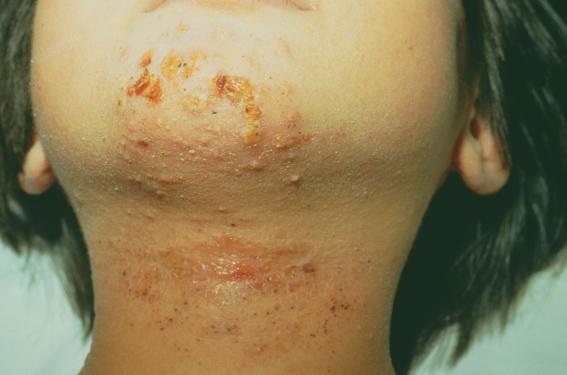
Le traitement par dupilumab peut aussi entraîner des effets dits paradoxaux, qui désignent l’apparition ou l’aggravation de symptômes ou de maladies habituellement améliorés par le traitement. La survenue d’un psorias i s chez un certain nombre de patients traités par un anti-TNF pour une maladie inflammatoire chronique de l’intestin en est un exemple bien connu. Ces effets reflètent le déséquilibre inflammatoire induit par le blocage des cytokines de type 2. Trois grands types de ces effets paradoxaux sous dupilumab ont été décrits : eczéma de la tête et du cou, pelade et psoriasis, dont 3 cas de psoriasis pustuleux déclarés suite à un appel à cas lancé par le GREAT. La stratégie thérapeutique dans ce contexte n’est pas encore bien codifiée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :