Publié le 09 déc 2020Lecture 4 min
Carcinome épidermoïde cutané avancé : vers une nouvelle ère thérapeutique
Catherine FABER, Paris
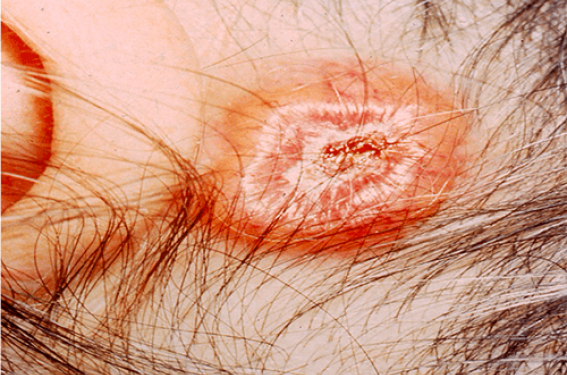
Le carcinome épidermoïde cutané au stade avancé pose un problème croissant dans les services hospitaliers, mais aussi en dermatologie libérale. L’année 2019 a été marquée par les résultats très prometteurs des anti-PD1 qui donnent des taux de réponse allant jusqu’à près de 45 % et, surtout, des réponses durables avec une survie qui s’allonge.
Les carcinomes épidermoïdes cutanés (CEC) représentent environ 20 % de tous les cancers cutanés, soit une incidence annuelle de 30/100 000 habitants en France. Entre 2 % et 5 % — environ 1 000 patients par an — sont des stades avancés (CECa). Ces formes avancées sont, d’une part, les CEC localement avancés non éligibles à la chirurgie ou à la radiothérapie du fait d’un envahissement des couches plus profondes de la peau ou des structures environnantes et, d’autre part, les CEC métastatiques avec des atteintes ganglionnaires ou à distance (respectivement 60 % et 40 % des cas(1)). Avec les nouvelles thérapeutiques, se pose aussi la question d’inclure dans la définition du CECa les cas pour lesquels la chirurgie sera trop délabrante ou non-R0, et impliquant une radiothérapie qui peut être difficile et parfois contre-indiquée. Quoi qu’il en soit, la décision doit être prise en RCP.
Les chimiothérapies à base de sels de platine restent les traitements médicaux de référence des CECa, mais les protocoles sont issus de l’expérience des ORL. L’un des rares essais thérapeutiques en dermatologie fait état d’un taux de réponse complète de 34 % et d’une médiane de survie de 14,6 mois avec la combinaison cisplatine-interféron-acide rétinoïque*(2). La toxicité digestive, rénale et hématologique des chimiothérapies cytotoxiques, avec en particulier un risque de sepsis, pose problème chez les patients qui sont souvent âgés et fragiles. Par ailleurs, deux essais prospectifs ont validé les anti- EGFR. Ils montrent que le cétuximab(3) et le panitumumab(4) permettent d’obtenir un taux de réponse globale de, respectivement, 28 % et 31 %, une médiane de survie de 4,1 et 8 mois et une survie globale moyenne inférieure à 12 mois. Les anti-EGFR en monothérapie ont l’avantage de ne pas entraîner d’effets indésirables graves extracutanés.
* Les rétinoïdes ne sont plus utilisés dans cette indication.
Trois essais thérapeutiques avec les anti-PD1
Derniers arrivés dans ce domaine, les anti-PD1 ont fait l’objet de trois essais de phase II dans le CECa dont les résultats ont été présentés aux congrès annuels 2019 de l’ASCO (American Society of Clinical Oncology) puis de l’ESMO (European Society for Medical Oncology) : l’étude 1540 pour le cémiplimab(5,6) et les études CARSKIN et KEYNOTE-629 pour le pembrolizumab(8,9).
Avec le cémiplimab, le taux de réponse globale dans le CEC localement avancé est de 43,6 % (n = 115 patients)(5). Les taux de survie sans progression (SSP) et de survie globale (SG) à 12 mois atteignent, respectivement, 58,1 % et 93,2 %. La réponse apparaît dans un délai médian de 1,9 mois et, en cas de réponse partielle, peut se compléter au bout de plusieurs mois, voire de plus d’un an et même après l’arrêt du traitement. Il y a peu de progression, comme en témoigne le taux de réponse persistante à 12 mois, qui est à 87,8 %.
Chez les patients avec CEC métastatique ganglionnaire ou à distance (n = 115) traités par cémiplimab à la dose, soit de 3 mg/kg IV toutes les 2 semaines (groupe 1), soit de 350 mg toutes les 3 semaines (groupe 3 ; dose actuellement recommandée), le taux de réponse globale est de 44,3 %(6). Dans le groupe 1, la médiane de SSP est de 18,4 mois et la survie globale à 24 mois de 70,6 %. Dans le groupe 3, on note une SSP de 10,4 mois et une SG à 12 mois de 76,1 %. Là encore, la réponse est précoce (médiane de 2,1 mois) et le taux de réponse persistante à 12 mois élevé (89,9 %).
Chez les patients avec CEC inopérable traités en première ligne par pembrolizumab (n = 39), le taux de réponse à 15 semaines est de 38,5 %, le taux de SSP à 6 mois de 66 % et la médiane de SSP de 14,2 mois(7). Dans le CEC récurent et/ou métastatique (n = 105 patients), les résultats correspondants sont de 34,3 %, 50,4 % à 6 mois et 32,4 % à 12 mois, et 6,9 mois à 6 mois(8).
Sur le plan de la toxicité, des effets indésirables (EI) de grade élevé (≥ 3) ont été observés chez 42 % et 45,2 % des patients selon les groupes. Mais ceux ayant conduit à un arrêt du traitement sont rares (7,7 % et 7,8 %)(5,6). Deux patients sont décédés dans le groupe 1, dont un d’une cause non liée au traitement. Le décès répertorié dans le groupe 3 est, lui aussi, non lié au traitement. D’après les données sur le pembrolizumab(7), les EI immunomédiés sont rarement de grade élevé et correspondent à ceux décrits avec les anti-PD1 dans d’autres pathologies comme le mélanome.
Vie réelle et nouvelles perspectives
La première étude en vie réelle du cémiplimab dans le traitement des CECa a donné des résultats proches de ceux des essais disponibles, avec une tolérance qui semble identique aux immunothérapies dans d’autres in dications. En pra tique, l’immunothérapie par anti-PD1 n’est pas contre-indiquée chez les patients âgés. Elle semble avoir peu d’impact sur l’autonomie. Une attention particulière doit être portée à certaines populations de patients comme les greffés, chez qui les CEC sont fréquents, et les patients ayant des antécédents de maladie auto-immune.
Le cémiplimab est, à ce jour, le seul anti-PD1 autorisé dans les CECa. Il obtenu l’appro bation de la FDA en septembre 2018 et a fait son entrée en tant que traitement de première ligne des récidives régionales de CEC et des CEC métastatiques à distance dans les dernières recommandations américaines du NCCN (National Comprehensive Cancer Network, octobre 2019). Il a une AMM européenne conditionnelle depuis juin 2018 « en monothérapie pour le traitement de patients adultes atteints d’un carcinome épidermoïde cutané métastatique ou localement avancé qui ne sont pas candidats à une chirurgie curative ni à une radiothérapie curative ». Ses résultats justifient une réactualisation des recommandations françaises, qui datent de 2009.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :