Publié le 05 juin 2020Lecture 14 min
Les hémangiomes infantiles : efficacité des bêtabloquants
Omar BOUGHENE STAMBOULI, CHU TIemcen, Faculté de médecine, Algérie
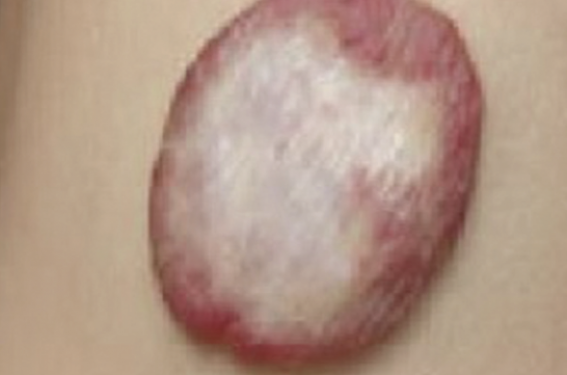
Les anomalies vasculaires représentent une pathologie rare et fréquemment méconnue du monde médical.
Elles peuvent être divisées en deux catégories distinctes dont le pronostic et la prise en charge sont radicalement différents : les tumeurs vasculaires et les malformations vasculaires. Les tumeurs vasculaires se caractérisent par une prolifération endothéliale bénigne dans la majorité des cas, la plus fréquente d’entre elles étant l’hémangiome infantile.
L’ hémangiome infantile (HI) est une pathologie qui a fait l’objet depuis 20 ans d’une recherche clinico-biologique intensive, ce qui a permis de décrypter les divers facteurs et cellules impliqués dans l’évolution de cette pathologie.
Cette tumeur se caractérise par une atteinte des cellules endothéliales qui tapissent les vaisseaux sanguins, cellules qui vont se multiplier de manière anormalement rapide, formant ainsi une masse colorée rouge. À la naissance, l’hémangiome est souvent absent ou se caractérise par une simple tache prémonitoire associée ou non à des petits vaisseaux sanguins dilatés.
Il peut ensuite croître les 3 premiers mois puis se stabiliser au cours de la première année de vie.
Dans tous les cas, cette tumeur disparaît spontanément, mais laisse parfois des séquelles plus ou moins importantes.
Dans près de 80 % des cas, les HI ne nécessitent aucun traitement. Ce dernier ne sera alors envisagé que s’il y a un risque vital, fonctionnel, ou de séquelle esthétique pour l’enfant ou une ulcération.
Le traitement sera d’autant plus efficace qu’il est prescrit tôt et qu’il fait l’objet d’une surveillance rigoureuse et d’une prise en charge médicale pluridisciplinaire.
Définition, généralités
L’hémangiome infantile est la tumeur la plus fréquente du nourrisson, sa physiopathologie reste cependant encore mal connue(1). L’hémangiome infantile se développe au cours des premières semaines de vie, il se constitue habituellement en 3 à 6 mois, puis régresse très lentement sur une durée de 3 à 7 ans.
Il serait la conséquence d’un processus d’angiogenèse pathologique dû à une ischémie survenue au cours de la vie foetale au niveau d’un territoire cutané. Ils trouvent leur origine dans la période embryonnaire. Normalement l’organisation du système vasculaire dans la peau est achevée dans les dernières semaines de la grossesse.
Si cette maturation n’est pas terminée à la naissance, certains vaisseaux restent exposés à la stimulation de facteurs angiogènes. Il en découle une prolifération excessive et la formation de tumeurs vasculaires.
Les 3/4 des hémangiomes sont de forme nodulaire et ne sont pas associés à des malformations(1). En revanche, les hémangiomes dits segmentaires peuvent être associés à des anomalies du développement(1).
Du fait d’une involution spontanée, la plupart des hémangiomes du nourrisson ne nécessitent pas d’intervention thérapeutique(1). Dans 10 à 15 % des cas, un traitement est nécessaire, en raison de complications : pronostic vital engagé, menace fonctionnelle, complication locale ou encore quand le risque esthétique est trop élevé à long terme(2).
Épidémiologie
Incidence
L’hémangiome infantile est la tumeur bénigne la plus fréquente de l’enfant, touchant 4 % à 10 % des nourrissons de moins d’un an et jusqu’à 25 % des prématurés de moins de 1 500 g(4).
Ils sont plus fréquents chez les filles : 2,5 à 4 filles pour 1 garçon. La prédominance est encore plus nette pour les formes graves (PHACES) avec 9 filles touchées pour 1 garçon(1).
Il est classiquement dit que les HI siègent préférentiellement dans la région céphalique, mais une étude épidémiologique récente tend à montrer que les HI sont également repartis sur le tégument(5).
Clinique
Les aspects cliniques : trois formes d’hémangiomes immatures peuvent être distinguées :
l’hémangiome cutané : il est purement cutané (également appelé tubéreux) : rouge vif, à bords nets, en relief, saillant sur le tégument normal avoisinant, à surface mamelonnée irrégu lière (figure 1A et B et 2) souvent décrit comme une « fraise » ;
l’hémangiome sous-cutané : il constitue une tuméfaction, sous-cutanée, saillante, chaude, mais non battante, sous une peau saine ou discrètement bleutée et/ou télangiectasique (figure 3A et B) ;
l’hémangiome mixte : c’est l’association d’une composante superficielle tubéreuse apparaissant en premier et d’une composante profonde qui soulève et déborde la première d’un halo bleuté (figure 4A et B).
Les trois quarts des HMG évoluent sur ce mode. La nappe cutanée apparaît la première, la composante sous-cutanée se développe secondairement et soulève, en la débordant, la zone rouge(3).
Figure 1A et B. Hémangiomes infantiles superficiels.
Figure 2. Hémangiomes infantiles superficiels en phase de régression.
Figure 3A et B. Hémangiomes infantiles sous cutané.
Figures 4A et B. Hémangiomes infantiles mixte.
Notre expérience
L’hémangiome infantile (HI) est la tumeur la plus fréquente chez l’enfant. En raison de leur involution naturelle en quelques années sans séquelles ma jeures, dans la majorité des cas, l’abstention thérapeutique est de règle.
Seules les formes compliquées seront traitées (figures 5, 6, 7, 8). La découverte de l’action spectaculaire des bêtabloquants sur les hémangiomes infantiles a transformé le pronostic des hémangiomes à risque.
Figure 5A. Hémangiome infantile narinaire B. Hémangiome infantile narinaire avec nécrose et destruction.
Figure 6. Hémangiome cervico-facial.
Figure 7A et B. Hémangiomes nécrosés et ulcérés.
Figure 8A et B. Hémangiomes infantiles de la lèvre inférieure engageant le pronostic fonctionnel.
L’objectif
Étudier la réponse et la tolérance des différents bêtabloquants et les différents facteurs influençant la réponse thérapeutique.
Matériel et méthode
Étude prospective allant de 1er janvier 2015 jusqu’au 30 juin 2018 au niveau du service de dermatologie CHU Tlemcen Algérie, portant sur 166 enfants avec hémangiome infantile ayant une indication de traitement par les bêtabloquants.
Résultats
Sur une période de 42 mois, nous avons colligé 166 patients. L’âge moyen était de 3,81 ± 1,33 mois, 78 % des cas étaient de sexe féminin.
Dans notre échantillon, la notion d’intervalle libre était quasi constante. Le délai moyen de modification de la lésion prémonitoire était de 27,98 jours.
La forme tubéreuse était trouvée dans 47,76 % des cas, 4,97 % avaient une forme sous-cutanée.
La forme mixte a intéressé 81 nourrissons (40,29 %).
Les lésions étaient multiples chez 15,7 % des patients. Les indications thérapeutiques étaient l’ulcération dans 37,34 % des cas, la présence d’un risque fonctionnel dans 50 % des cas (figures 9, 10 et 11), la présence d’un risque esthétique dans 33,13 % des cas et d’un risque vital dans 4,21 % des cas.
Nous avons trouvé un taux de 28,6 % d’effets secondaires qui sont majoritairement mineurs. Après six mois de traitement, la réponse était favorable chez 145 nourrissons, soit 87,34 % de la population d’étude.
La réponse thérapeutique était complète dans 17,5 % et quasi complète dans 69,9 % des cas. Une étude analytique univariée objectivait que les facteurs de bonne réponse thérapeutique étaient la localisation cervico-thoracique (p = 0,001), la répartition segmentaire (p = 0,001), le siège péri-orificiel ; les hémangiomes de taille > 3 cm (p = 0,001).
Figure 9A et B. Hémangiomes infantiles distaux engageant le pronostic fonctionnel.
Figure 10A et B. Hémangiomes infantiles du pavillon de l’oreille.
Figure 11A, B et C. Autres hémangiomes infantiles avec engagement du pronostic fonctionnel.
La prise en charge thérapeutique
La répartition de la population d’étude selon le traitement
Dans notre échantillon (figure 12), 101 cas ont été traités par propranolol soit 60,8 %, 25 cas par aténolol soit 15,1 % et 40 cas sont traités par timolol soit 24,1 %.
Le choix du traitement était discuté au cas par cas en fonction du rapport risque/bénéfice de la voie orale, la forme clinique et la taille de l’hémangiome infantile. Le traitement par aténolol était justifié soit par la présence des antécédents de bronchiolites chez ces nourrissons, soit en présence de troubles du sommeil.
Figure 12. Répartition de la population d’étude selon le type de bêtabloquant.
Indication thérapeutique
Le traitement a été indiqué devant la présence d’une ulcération, un préjudice esthétique et/ou fonctionnel ou un pronostic vital engagé.
Dans notre série, tous les malades ayant plus d’un hémangiome infantile, un seul a posé l’indication thérapeutique.
Un hémangiome infantile peut comporter un ou plusieurs risques, en présence d’une ulcération et une localisation délicate par exemple.
Nous citons les principaux risques recensés dans notre étude (figure 13) :
ulcération : 63 cas soit 37,34 % de la population ;
risque fonctionnel : 83 cas soit 50 % de la population ;
risque esthétique : 55 cas soit 33,13 % de la population ;
risque vital : 7 cas soit 4,21 %.
Figure 13. Répartition de la population d’étude selon le risque et les complications.
Résultats thérapeutiques
Le traitement par propranolol a été administré sur une période moyenne de 9,18 ± 4,4 mois avec des limites variantes entre quelques jours à 18 mois du traitement pour les hémangiomes à risque de récidive.
Effets communs sur tous les hémangiomes
Dès l’instauration du traitement, 86,7 % de la population (144 nourri ssons) a présenté une modification de la coloration de leur hémangiome, marquée par un éclaircissement passant d’un rouge vif ou rouge bleuté en rose pâle (figure 14).
Cette variation colorimétrique a été la première modification de la lésion observée, apparaissant dès les premières heures ou au cours de la première semaine. L’absence de cette modification colorimétrique a été constatée chez 12 malades sous propra - nolol, 3 sous aténolol et 5 nourrissons sous timolol (figure 15).
Figure 14. Répartition de la population selon la réponse immédiate aux bêtabloquants
Figure 15. Évaluation de la réponse immédiate selon le type de bêtabloquant.
La réponse à un mois
La réponse thérapeutique a été jugée très bonne chez 48 malades (28,9 %), bonne chez 94 (56,6 %).
Une détérioration a été notée chez 3 nourrissons.
La réponse était considérée comme insuffisante chez 23 nourrissons. Un arrêt précoce du traitement a été imposé chez 3 malades après un événement pathologique sévère (figure 16). Cet arrêt a concerné les 3 types de bêtabloquant (figure 17).
Figure 16. Répartition de la population selon la réponse thérapeutique à un mois.
Figure 17. La réponse thérapeutique à un mois en fonction du type de bêtabloquant.
La réponse thérapeutique
24e semaine
Après 6 mois de traitement, le critère de jugement principal a été évalué selon les recommandations HAS, la réponse était favorable chez 145 nourrissons soit 87,34 % de la population d’étude.
La réponse thérapeutique était complète dans 17,5 % et quasi complète dans 69,9 % des cas. L’efficacité thérapeutique a concerné 89 nourrissons sous propranolol soit 88,1 % des cas, 22 malades sous aténolol soit 88 % des cas et 34 malades sous timolol soit 85 % de réponse favorable.
L’échec thérapeutique a concerné 5 nourrissons dont 2 sous propranolol, 2 sous aténolol et 1 malade sous timolol (tableau 1). Le traitement n’a pas été achevé à 6 mois chez 5 malades de la population d’étude.
48e semaine
Une deuxième évaluation thérapeutique a été faite à la 48e semaine afin de s’assurer de l’absence de récidive chez les malades dont la durée de traitement a été achevée ou dans le cadre de suivi thérapeutique chez les malades recevant encore la molécule.
La réponse était également favorable dans 88 % des cas, complète chez 65 nourrissons soit 39,2 %, dont 38 malades sous propranolol, 13 sous aténolol et 14 sous timolol.
En tout, 81 nourrissons ont présenté une réponse favorable quasi complète soit 52 malades sous propranolol, 9 sous aténolol et 20 sous timolol (tableau 2).
En cas de réponse quasi complète, un reliquat fibro-adipeux était observé chez 8 malades, une lésion maculaire ou télangiectasique chez 56 malades et l’association des deux chez 16 malades (tableau 3).
Nature de la lésion résiduelle
Switch entre bêtabloquants
Dans notre échantillon, 77,1 % des nourrissons ont reçu un seul bêtabloquant en monothérapie.
Le passage d’un bêtabloquant à un autre a concerné 37 cas (figure 18).
Le switch a consisté à un passage du propranolol à l’aténolol chez 9 nourrissons soit 5,4 % de la population, du timolol – propranolol chez un malade soit 0,6 % des cas et d’un bêtabloquant par voie orale au timolol chez 28 cas soit 16,9 % des nourrissons (figure 18).
Figure 18. Répartition de la population selon le switch entre les bêtabloquants.
Le passage d’une molécule à une autre était basé sur des éléments différents selon le contexte clinique et la tolérance thérapeutique chez ces nourrissons (figures 19 et 20).
La substitution du propranolol par aténolol était justifiée par une intolérance thérapeutique essentiellement les bronchiolites à répétition ou les épisodes de bronchospas me à répétition.
Chez les 9 malades chez qui on a arrêté le propranolol, l’aténolol était mieux toléré.
Le timolol a été introduit en cas de récidive à l’arrêt du traitement ou en complément de traitement chez les malades ayant une réponse thérapeutique satisfaisante pendant la phase supposée de croissance ne justifiant pas le maintien de la voie orale.
L’apparition d’une ulcération sous timolol a justifié le passage à un traitement systémique chez 2 malades (figure 19).
Le délai d’introduction du deu xième bêtabloquant était variable : précoce après quelques jours chez 2 malades, au deuxième mois du traitement chez 10 cas, et après le sixième mois de traitement chez 19 nourrissons (figure 20).
Figure 19. Motif de switch entre les bêtabloquants.
Figure 20. Le délai d’introduction du deuxième bêtabloquant.
Tolérance/effets secondaires
Dans la population étudiée (figure 21 et tableau 4), les principaux effets secondaires sont représentés par :
un bronchospasme chez 31 cas soit 18,7 % : majoritairement de façon transitoire et de résolution rapide lors des périodes d’infections virales des voies respiratoires supérieures, apparu quelque mois après l’introduction du traitement, exceptionnellement à l’instauration de façon précoce justifiant dans ce cas le changement du propranolol par l’aténolol chez 5 cas ;
un retard de l’âge de la marche chez 2 enfants et un retard de langage chez 2 autres (2,4 % des cas) ;
44 nourrissons ont présenté une diarrhée au début du traitement (soit 25,9 % de la population) ;
38 cas soit 22,9 % de la population ont présenté des troubles de sommeil et des cauchemars.
Figure 21. Répartition des cas selon les effets secondaires en pourcentage.
Ces effets étaient transitoires et notés lors de l’instauration du traitement et/ou l’augmentation des doses et n’ont pas nécessité l’arrêt du traitement.
Un arrêt définitif du traitement par un bêtabloquant était impératif chez 5 cas et a intéressé un malade sous aténolol à cause d’une bradycardie mal tolérée cliniquement, 3 malades sous propranolol à cause de crises de bronchospasmes sévères justifiant le passage à une autre classe de bêtabloquant type timolol chez 2 cas et aténolol chez 1 cas.
Un arrêt définitif a été répertorié chez un cas sous timolol ayant présenté une hyperkaliémie grave et justifiant le passage à une corticothérapie par voie générale.
Bradycardie
La baisse de la fréquence cardiaque était constante chez tous les malades mis sous bêtabloquant par voie générale, quasi absente dans la forme topique. Dans notre série, la fréquence cardiaque a baissé d’une moyenne de 6 (± 7) battements/ minute par rapport à l’état initial avec des valeurs variantes de 0 à 50 battements/ minute (tableau 5).
Effet rebond
Une reprise évolutive de l’hémangiome infantile a été observée dans 21,68 % à l’arrêt du traitement dans notre série (figure 22). Une recoloration après arrêt du traitement a intéressé 6 cas sous timolol, 8 sous aténolol et 22 sous propranolol.
L’effet rebond constaté dans notre étude était représenté par une récidive de l’hémangiome infantile à l’arrêt du traitement chez 6 malades ayant une composante mixte avec une progression importante de la taille de la tumeur et par une simple recoloration sans augmentation de la taille chez les 30 malades restants.
Nous remarquons que le délai de survenue est de quelques jours après l’arrêt du traitement sans dépasser 1 mois.
Figure 22. Répartition de la population selon l’effet rebond à l’arrêt du traitement.
Figure 23. Répartition de l’effet rebond selon le type de Bêtabloquant.
Étude analytique du critère de jugement principal
L’étude univariée
La comparaison des deux moyennes avant et après traitement pour l’ensemble de l’échantillon indépendamment de tout facteur pronostique a montré une différence statistiquement très significative t (165) = 10,43 (p < 10-3) (tableau 6).
L’étude bivariée
Pour effectuer l’analyse bivariée nous n’avons pris que les malades ayant eu un seul hémangiome infantile soit 140 malades. Les 26 malades non inclus dans cette analyse bivariée étaient des enfantss avec des hémangiomes multiples :
dont un seul hémangiome a posé l’indication thérapeutique ;
des réponses thérapeutiques hétérogènes chez le même malade.
Discussion
Notre étude corrobore les publications antérieures (taux de régression entre 50 et 96 %) et montre une corrélation significative de la réponse au traitement avec les hémangiomes de grande taille, avec une localisation cervico-céphalique par rapport aux autres localisations et avec les hémangiomes segmentaires par rapport la configuration localisée et la localisation per orificielle au niveau cervico-céphalique.
L’hémangiome cutané infantile est une tumeur vasculaire bénigne présente chez 10 % des nourrissons(5).
Il fait partie du groupe des tumeurs vasculaires dans la classification de « International Society for Vascular Anomalies » (ISSVA). Classiquement, il se présente sous forme d’une masse ou tache cutanée rouge, d’une masse sous-cutanée ou, le plus souvent, d’une forme mixte associant les deux aspects.
Depuis les observations historiques en 2008 de Léauté- Labrèze et coll.(5), les bêta-bloquants, en particulier le pro pranolol, sont devenus ces dernières années le traitement médical de première ligne des hémangiomes compliqués.
Notre étude(2) est une cohorte colligeant 166 patients sur une période de trois ans et six mois allant du 1er janvier 2015 au 30 juin 2018. Les principaux résultats de notre étude : l’âge moyen était de 3,81 ± 1, 33 mois, 7 sex ratio = 0,28.
Les formes cliniques de l’hémangiome étaient tubéreuses (47,76 %), sous-cutanée (4,97 %) mixte (40,29 %).
Les indications thérapeutiques étaient l’ulcération (37,34 %), un risque fonctionnel (50 %), un risque esthétique (33,13 %) et un risque vital (4,21 %).
La comparaison des deux moyennes avant et après traitement pour l’ensemble de l’échantillon indépendamment de tout facteur pronostique a montré une différence statistiquement très significative t(6) = 10,43 (p < 10-3).
Une étude analytique univariée objectivait que les facteurs de bonne réponse thérapeutique étaient la localisation cervicocéphalique (p = 0,001), la répartition segmentaire (p = 0,001), le siège péri-orificiel, l’hémangiome infantile de grande taille (p = 0,001).
Discussion du profil thérapeutique
Prise en charge thérapeutique
La répartition de la population d’étude selon le type de traitement
60,8 % des nourrissons sont traités par le propranolol, 15,1 % par l’aténolol et seulement 24,1 % par le timolol topique.
Le choix de la molécule a été fait en fonction du pronostic engagé, les antécédents et le contexte clinique du pa tient.
Le propranolol était globalement indiqué en première intention.
L’aténolol était recommandé d’emblée chez les enfants ayant une histoire clinique de bronchiolites à répétition, histoire d’hypoglycémie ou trouble de sommeil, secondairement en cas d’intolérance au propranolol.
En effet, l’aténolol est un bêtabloquant cardiosélectif. Dans notre série, l’introduction de cette molécule était bien tolérée. Dans une étude de noninfériorité(1, 5, 6) comparant le propranolol à l’aténolol, Bayart et coll. a prouvé son efficacité dans une série de 27 nourrissons traités par aténolol versus 53 nourrissons traités par propranolol. Il a pris comme outil d’évaluation le HAS (Hemangioma Activity Score) et n’a montré aucune différence statistiquement significative entre les deux groupes (p = 0,60).
Le timolol était utilisé seulement sur les hémangiomes de petite taille et/ou ulcéré et dont la localisation n’engage pas un risque esthétique majeur.
Conclusion
• Les bêtabloquants permettent une diminution rapide de la taille des hémangiomes avec peu d’effets secondaires. Une durée de plus de six mois est nécessaire pour certains hémangiomes avec participation sous-cutanée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :