Publié le 14 sep 2011Lecture 11 min
Actualités des médicaments induisant une photosensibilité
J.-L. SCHMUTZ Service de dermatologie, CHU de Nancy
L’état de photosensibilisation correspond à un processus qui rend la peau sensible à la lumière par l’intermédiaire de substances photosensibilisantes. Le médicament va jouer ce rôle, soit par voie systémique soit après application locale.
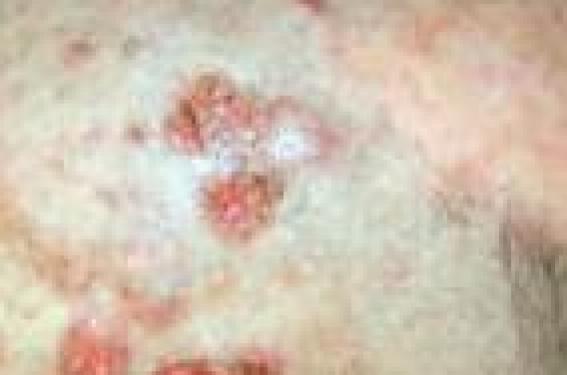
Les UVA sont le plus souvent impliqués dans les phénomènes de photosensibilisation, car ils pénètrent la peau plus profondément que les UVB. La photosensibilisation se traduit par deux types de réaction qui s’opposent point par point : – la réaction phototoxique survient en principe chez tous les individus dès la première exposition à condition que la peau subisse une exposition solaire suffisante et qu’elle contienne une substance chimique douée du pouvoir phototoxique à des concentrations suffisantes ; – la réaction photoallergique est une réaction d’hypersensibilité à médiation cellulaire. Elle nécessite une sensibilisation préalable et ne survient que chez certains sujets prédisposés. L’énergie lumineuse est nécessaire pour produire un photoantigène qui va induire la réaction immunoallergique. Réactions photoallergiques Les AINS En 2010, nous avons vécu la saga(1) du Kétum® (kétoprofène). En effet, nous avons failli voir disparaître ce médicament. L’Afssaps a demandé son retrait en raison de l’efficacité faible à modérée, de la persistance de survenue de cas de photoallergie malgré la prise de nombreuses mesures précédemment décrites. L’Afssaps a considéré que le risque lié à l’utilisation des gels de kétoprofène était supérieur au bénéfice attendu et qu’une mesure supplémentaire à celle prise précédemment ne pouvait garantir davantage de sécurité des patients. Les laboratoires Menarini, suite à une requête en référé suspension auprès du Conseil d’État, a obtenu la possibilité de remettre le Kétum® gel sur le marché. En conséquence, nous allons continuer à voir des eczémas de contact et des photosensibilisations au kétoprofène (figure 1/illustration) en sachant qu’il existe des réactions croisées avec l’acide tiaprofénique, le fénofibrate, l’oxybenzone et dernièrement l’octocrylène, substance utilisée comme filtre solaire. Depuis 2002, date de la première description par une équipe lilloise, les cas se multiplient. Un registre de suivi a été mis en place. Les notifications des membres du Revidal-GERDA et de la Société française de photodermatologie viennent d’être publiées (2). En 2010, 117 patients avaient des photo-patch-tests positifs. Ces patients se répartissaient en trois groupes : les enfants font plutôt un eczéma de contact ; les adultes font plus volontiers une photoallergie de contact et ont très souvent un antécédent de photoallergie de contact au kétoprofène ; enfin, pour le 3e groupe, le phototest est positif lors de l’exploration de photoallergie au kétoprofène, sans pertinence clinique par rapport à l’octocrylène. Par ailleurs, au cours de sa séance plénière de juillet 2010, le comité scientifique de l’EMA (Agence européenne du médicament) s’est prononcé en faveur du maintien des médicaments contenant du kétoprofène et destinés à être appliqués sur la peau. Ce maintien sur le marché européen s’accompagne des dispositions qui avaient été prises par l’Afssaps pour minimiser le risque de photoallergie. Le comité scientifique de l’EMA s’est prononcé en faveur du maintien des médicaments contenant du kétoprofène et destinés à être appliqués sur la peau. Si le kétoprofène est un photoallergène souvent incriminé en France, il semble l’être beaucoup moins dans d’autres pays comme le Portugal (3), où l’on retrouve comme principaux anti-inflammatoires non stéroïdiens (AINS) photosensibilisants le piroxicam et la benzydamine. L’étofénamate est un AINS appartenant au groupe des fénamates comme le méclofénamate, l’acide niflumique (Nifluril ® gélule et Niflugel®) et l’acide méfénamique, non commercialisé en France ; il est en Espagne le deuxième photoallergène après le kétoprofène (4). Les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) Les ISRS sont un groupe largement prescrit d’antidépresseurs. Des accidents de photosensibilisation peuvent être en rapport avec la prise de fluvoxamine (Floxyfral®) ou de paroxétine (Déroxat®) (5). Ces réactions photoallergiques font suggérer des réactions croisées entre les différentes molécules et, pour les auteurs de l’article, il faut contreindiquer l’ensemble de la classe médicamenteuse en cas d’accident à l’un d’eux. Le mécanisme est inconnu, mais les inhibiteurs sélectifs de la recapture sont métabolisés par le cytochrome P450. Si la molécule mère ne semble pas en cause, un métabolite déméthylé pourrait être incriminé. Les photopatch- tests se révéleront positifs. Il est, par ailleurs, préconisé de faire attention à une éventuelle photothérapie, particulièrement par les UVB car 2 patients (sous paroxétine) sur 3 ont fait une réaction positive en UVB lors de l’exploration photobiologique et non en UVA. Le patient sous fluvoxamine a fait en revanche une réaction en UVA. Il faut contre-indiquer l’ensemble des inhibiteurs sélectifs de recapture de la sérotonine en cas d’accident avec l’un d’eux. Les statines Les statines peuvent être en cause dans des réactions de photosensibilités. Une équipe espagnole (6) rapporte 2 cas d’érythème polymorphe photo-induit, l’un par la simvastatine (Lodales®, Zocor®, Inegy®) et l’autre par la pravastatine (Elisor®, Vasten®, Pravadual®). Il s’agissait dans le premier cas d’une femme de 75 ans qui se plaignait depuis 12 ans d’éruptions à répétition sur les parties découvertes. La deuxième observation était celle d’un homme de 54 ans, se plaignant d’une éruption depuis une semaine avec des lésions prurigineuses sur le visage et le dos des mains. Dans les deux cas, une photoallergie à une statine fut suspectée. L’exploration photobiologique pratiquée avec poursuite de la prise du médicament pendant l’exploration retrouvait une DEM abaissée en UVA et en UVB. Les photo-patch-tests avec la simvastatine étaient non interprétables car un érythème est apparu sur l’ensemble de la zone exposée. La réalisation d’une nouvelle exploration 9 mois après l’arrêt du médicament permettait de retrouver une DEM normale et aucun érythème avec 10 J/cm2. Une DEM abaissée en UVB à 0,05 J/cm2 fut également retrouvée chez le deuxième patient alors qu’il prenait toujours la pravastatine. Cette DEM redeviendra normale 3 mois plus tard. Quatorze sujets contrôles asymptomatiques sous statines avaient une DEM normale en UVB. Les deux patients n’ont pas eu de récidive à l’arrêt du traitement. Lupus érythémateux subaigus induits De nombreux médicaments peuvent induire des lupus érythémateux subaigus comme certains médicaments antihypertenseurs ou la terbinafine. La première description de lupus induit date de 1985 avec une série de 5 patients sous hydrochlorothiazide. A.A. Funke et coll. (7) rapportent les observations de 3 femmes atteintes de cancer du sein qui ont développé une éruption de type lupus érythémateux subaigu après traitement par doxorubicine (Adriblastine®, Caelyx®, Myocet ®) et cyclophosphamide (Endoxan®). Les auteurs ont retrouvé un seul cas de lupus subaigu induit dans la littérature sous doxorubicine en 2009. Dans les deux premières observations, il s’agit de 2 femmes de 44 et 42 ans ayant des antécédents de lupus subaigu avec des anticorps anti-SSA, alors que dans la troisième observation, il s’agissait d’un lupus acquis chez une femme de 73 ans. Le mécanisme d’apparition est peut-être en rapport avec un effet photosensibilisant induit par les médicaments. Pour les taxanes, un relargage de nucléosome pourrait induire une maladie auto-immune, et de manière similaire, on a incriminé une destruction de la couche basale des kératinocytes par le fluoro-uracile ou la capécitamine (Xeloda®) en combinaison avec les UVB. Il est possible que l’effet toxique du cyclophosphamide et de la doxorubicine augmente le relargage de nucléosome. Par ailleurs, la doxorubicine est connue comme agent photosensibilisant pouvant éventuellement être responsable de l’induction ou de l’exacerbation de lupus érythémateux subaigu chez des patients prédisposés. Il est à noter que, dans la première observation, la poussée continue alors que les médicaments ont été arrêtés et remplacés par du paclitaxel (Taxol®) et du trastuzumab (Herceptin®). Or, P.R. Cohen (8) a rapporté un cas d’érythème polymorphe photodistribué et une photo-onycholyse chez une femme qui recevait un traitement adjuvant hebdomadaire par paclitaxel en traitement d’un carcinome canalaire. Dans la littérature, on retrouve 9 observations avec 5 cas d’onycholyse, 2 cas d’onycholyse et d’érythème polymorphe, 1 phénomène de photorémanence et 1 cas de lupus érythémateux subaigu. Les lésions ont disparu à l’arrêt du traitement. Dans plusieurs observations, il est à noter que les patients ont pu bénéficier de cycle de traitements additionnels de paclitaxel sans récidive en ayant adopté les règles de photoprotection. Voriconazole et phototoxicité Le voriconazole (VFend®) est un antifongique triazolé de 2e génération à large spectre, dérivé du fluconazole ayant une excellente activité in vitro envers une grande variété de levures et de champignons pathogènes. Il est indiqué dans la prise en charge des aspergilloses invasives, des candidémies chez les patients non neutropéniques, des infections invasives graves à Candida résistant au fluconazole, des infections fongiques graves à Scedosporium spp. ou Fusarium spp. Les effets secondaires sont multiples et variés, avec en premier lieu les troubles de la vision, la fièvre, les vomissements et les nausées. Figure 2. Carcinome spinocellulaire sous voriconazole. Les effets indésirables cutanés sont fréquents, parmi ceux-ci les réactions de photosensibilité, qui sont quelquefois très sévères avec parfois comme conséquence un photovieillissement prématuré. Des cas de lupus érythémateux discoïdes sont également rapportés ainsi que des tableaux de pseudoporphyrie par la révélation d’une authentique porphyrie cutanée tardive (9). Récemment, depuis 2007, plusieurs cas de carcinomes épidermoïdes cutanés multiples et agressifs sous voriconazole au long cours ont été rapportés dans la littérature faisant état de 18 cas (figure 2). La phototoxicité du voriconazole accélère les risques de carcinomes spinocellulaires chez les sujets immunodéprimés. Le mécanisme de photosensibilité n’est pas connu mais est vraisemblablement dû à un métabolite du médicament. Alors que le voriconazole n’est pas absorbé au niveau du spectre UVAUVB, le N-oxyde l’est et constitue certainement le chromophore responsable de la phototoxicité. Dernièrement, l’équipe de D.D. Miller et coll. a rapporté 5 cas de mélanomes in situ associés à l’utilisation au long cours du voriconazole chez 2 patients (10). Le développement de nombreuses lentigines très marquées, ainsi que de multiples mélanomes, permet peut-être de faire un rapprochement avec les patients sous PUVA ainsi que ceux atteints de Xeroderma pigmentosum. Plusieurs auteurs ont également émis l’hypothèse que le voriconazole aurait un effet indirect rétinoïde like. Comme le voriconazole, les rétinoïdes sont responsables de photosensibilité, d’érythème, de xérose et de chéilite. Les patients chez qui est instauré un traitement par voriconazole doivent prendre des précautions toutes particulières de photoprotection. Cette molécule doit être évitée chez les personnes ayant des signes de vieillissement cutané ou un antécédent de carcinome épidermoïde. Une étude rétrospective des effets indésirables du voriconazole se met en place. Il s’agit de l’étude Voripeau, coordonnée entre autres par Marie-Thérèse Leccia et le Centre régional de pharmacovigilance de Grenoble. Et les filtres solaires ? Un intérêt tout particulier est apporté à l’octocrylène qui voit le nombre de cas d’eczéma de contact et de photoallergie se multiplier. Se pose aujourd’hui la question de retirer ce produit des écrans solaires, mais il est à noter qu’il avait été introduit il y a une dizaine d’années en remplacement de l’oxybenzone, lui-même retiré en raison d’une « épidémie » d’allergies et de photoallergies de contact en sachant, par ailleurs, que l’octocrylène joue également un rôle de stabilisateur d’autres filtres. Conclusion De très nombreuses molécules sont à l’origine d’une réaction de photosensibilisation. Leur bonne connaissance nécessite une actualisation constante, de nouveaux agents étant régulièrement impliqués et rapportés dans la littérature.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :