Publié le 14 déc 2021Lecture 7 min
Cicatrisation normale et pathologique
Michèle DEKER, Paris
La cicatrisation comprend trois grandes étapes :
– une phase vasculaire et inflammatoire permettant le dépôt d’une matrice provisoire ;
– une phase de prolifération avec le développement d’un tissu de granulation et l’épidermisation ;
– enfin, la phase de maturation avec la formation de la cicatrice.
La première phase est marquée par un processus de détersion, important pour la cicatrisation future, la deuxième par le bourgeonnement. Toutes ces étapes peuvent être perturbées, faisant le lit de cicatrices pathologiques.
L’innervation cutanée joue probablement un rôle important dans le processus de cicatrisation. Elle est, certes, impliquée dans la douleur, mais pas exclusivement. La peau contient de multiples terminaisons nerveuses qui permettent le toucher, grâce à des mécanorécepteurs encapsulés pour la détection des pressions ou des vibrations, et à des terminaisons libres dans l’épiderme impliquées dans la perception de la douleur et de la température. La peau ne contient pas de neurones ; le corps cellulaire des neurones est présent au niveau des ganglions de la racine dorsale dans la moelle épinière. Tous les facteurs relâchés au niveau des terminaisons nerveuses lors d’une plaie jouent un rôle important dans les processus de cicatrisation. Cette reconnaissance du rôle de l’innervation cutanée a fait émerger la notion d’inflammation neurogène avec le relargage de nombreuses substances, telles la substance P, l’histamine, la sérotonine, qui vont entretenir l’inflammation. Plus l’état inflammatoire est prolongé, plus le risque de cicatrisation excessive est élevé.
La phase de prolifération est caractérisée par la multiplication sur le site lésionnel de fibroblastes qui acquièrent un phénotype myofibroblastique. Ces cellules possèdent des propriétés contractiles conférées par l’expression d’actine α-musculaire, et vont contracter la plaie. Elles sont également impliquées dans le dépôt de matrice extracellulaire, qui permet de combler la lésion pour remplacer le tissu lésé. Cette phase comprend une néoangiogenèse importante et s’accompagne d’épidermisation. Plus la couverture tégumentaire est rapide, moins les séquelles seront importantes. L’épithélium n’étant pas vascularisé, tous les nutriments nécessaires à la cicatrisation proviennent du derme, du néoderme ou du tissu de granulation. Les vaisseaux lymphatiques, présents au niveau de la peau mais peu étudiés, jouent probablement aussi un rôle dans la cicatrisation.
La phase de maturation est caractérisée par une réduction de la cellularité et une réorganisation vasculaire, avec la disparition des myofibroblastes et des cellules endothéliales, et une réorganisation de la matrice. Si cette phase est perturbée, les myofibroblastes demeurent et la matrice extracellulaire s’accumule, comme dans les cicatrices hypertrophiques.
Dans ces dernières, des rétractions vont apparaître. À cet égard, il ne faut pas confondre les cicatrices hypertrophiques et les cicatrices chéloïdes, qui font intervenir un facteur génétique et posent le problème des récidives. Il y a un fort parallélisme entre les mécanismes mis en jeu dans le processus de réparation tissulaire et le stroma qui se développe autour des lésions cancéreuses, qu’il s’agisse des mélanomes ou des lésions cancéreuses internes.
Les composants cellulaires sont les mêmes, ce qui fait dire que « le cancer est une plaie qui ne guérit pas ». À ce titre, de nombreuses thérapies du cancer visent le stroma très vascularisé qui nourrit la tumeur.
Le rôle du stress mécanique est un domaine d’intérêt particulier car les fibroblastes sont très sensibles à leur environnement mécanique par le biais de mécanorécepteurs. Une perturbation de cet environnement favoriserait la formation de cicatrices hypertrophiques. D’ailleurs, l’un des traitements visant à rétablir un équilibre mécanique et éviter les cicatrices hypertrophiques est la compression. Des dispositifs médicaux sont proposés pour gérer l’environnement mécanique, lesquels ont montré un bénéfice en limitant les cicatrices hypertrophiques. Il en est ainsi d’Embrace®, un dispositif qui allie un effet mécanique stabilisant la peau et du silicone, dont l’action est indéniable mais de mécanisme inconnu.
En pratique, les principes généraux de prise en charge des lésions cutanées sont :
– favoriser la cicatrisation par l’immobilisation ;
– prévenir les rétractions en posturant les zones lésées dans le sens de l’étirement cutané maximal ;
– limiter l’enraidissement par des postures alternées et des mobilisations actives ;
– masser mais très légèrement, pour ne pas entretenir une inflammation susceptible de favoriser les cicatrices hypertrophiques.
CLASSIFICATION DES CICATRICES
Les trois principales causes de cicatrices pathologiques sont le retard de cicatrisation, la persistance de l’inflammation et les forces mécaniques. L’éventail des cicatrices est large : étirées, atrophiques, contractées, hypertrophiques et chéloïdes.
Les cicatrices étirées apparaissent lorsque les lignes des cicatrices chirurgicales s’élargissent progressivement pendant les 3 premières semaines postchirurgie. Elle sont caractérisées par une tension élevée et une déchirure des fibres d’élastine. Les vergetures en donnent un bon exemple.
Les cicatrices atrophiques, plates et déprimées, apparaissent couramment après l’acné ou une infection staphylococcique.
Les cicatrices contractées surviennent lorsque l’activité des myofibroblastes est encore élevée. Elles sont fréquentes après des brûlures et ont tendance à s’hypertrophier.
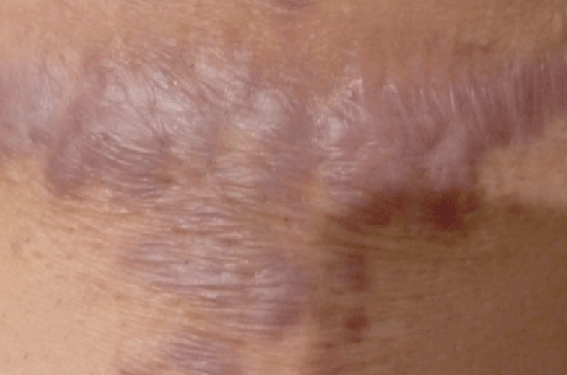
Les cicatrices hypertrophiées et les chéloïdes peuvent être différenciées selon la plaie d’origine ; les premières restent dans les limites initiales tandis que les chéloïdes ont tendance à déborder des marges de la plaie d’origine.
Les patients afro-américains sont 15 fois plus susceptibles de développer des cicatrices pathologiques. Des loci associés aux chéloïdes ont été identifiés sur certains chromosomes chez des patients japonais, afro-américains et chinois (Han).
Outre la génétique, les forces mécaniques jouent un rôle important dans la genèse des cicatrices pathologiques. En effet, les fibroblastes sont capables de détecter toutes les forces mécaniques et de réagir par le biais des voies de signalisation spécifiques. Par ailleurs, les glandes sébacées peuvent être impliquées dans les cicatrices pathologiques.
Ainsi, les chéloïdes touchent rarement les zones corporelles dénuées de glandes sébacées, telles les paumes et les plantes. Leur incidence est plus élevée à l’adolescence et au début de l’âge adulte, période de production très active de sébum. Enfin, les cicatrices hypertrophiques ou chéloïdes sont associées à une activité métabolique élevée (niveaux d’ATP très élevés) et les chéloïdes sévères à des niveaux élevés de pression artérielle.
La connaissance de tous ces facteurs de risque permet de guider la démarche thérapeutique en cherchant un équilibre entre l’inflammation, les paramètres métaboliques et les forces mécaniques.
COMMENT ÉVALUER LES CICATRICES ?
Les cicatrices se distinguent par plusieurs caractéristiques : surface, couleur, épaisseur, texture, souplesse/élasticité, rugosité, perturbation physiopathologique, impact esthétique, gêne fonctionnelle (prurit, douleur), impact psychologique. Chaque cicatrice est différente. Elle évolue dans le temps et avec le traitement. L’évaluation permet de décider ou poursuivre une thérapeutique, suivre son évolution, valider un traitement et son évolution.
Pour évaluer une cicatrice, les conditions de mesure doivent être respectées : patient au repos depuis 15 min, toujours à la même heure, dans une salle à température et hygrométrie constantes.
• Surface. La planimétrie évalue la rétraction ou l’élargissement de la cicatrice ; la surface peut être mesurée avec un centimètre, sur calque et par photographie. La mesure des volumes peut faire appel au moulage de la cicatrice et à la caméra 3D.
• Couleur. Ce paramètre va guider le traitement physique : plus une cicatrice est érythémateuse, ce qui témoigne de l’état inflammatoire, moins elle devra être manipulée. Deux paramètres sont évalués : la pigmentation et l’érythème. Il est difficile d’avoir une évaluation objective de la rougeur ; des outils tels que l’imagerie laser (en recherche) ou l’analyse de photographies digitales ou la spectrométrie le permettent. Le mexamètre évalue la pigmentation de la peau au moyen de petites sondes. Un outil très simple est le test de vitropression, qui mesure le temps de recoloration cutanée, témoignant de l’état inflammatoire de la peau.
• Épaisseur. En règle générale, l’évaluation subjective sous-estime l’épaisseur réelle de la cicatrice. On peut utiliser un appareil à ultrasons, qui capte l’image en 3D de la cicatrice.
• Texture. Des outils dérivés de l’industrie permettent d’évaluer la surface de la peau (rugosités).
• Souplesse/élasticité. Ces propriétés de la peau sont importantes à évaluer dans les cicatrices de brûlures, la rééducation ayant pour objectif de récupérer cette fonctionnalité. Le cutomètre permet de mesurer l’élasticité et la plasticité de la peau. Le DERMAL TORQUE METER® (Cosderma) mesure l’adhérence de la peau aux tissus sous-jacents par un mécanisme de torsion.
• Perturbations physiopathologiques. La mesure de l’oxygène transcutané (TcPO2 ) est utile : plus faible dans la peau cicatricielle, son augmentation est corrélée à la diminution de l’épaisseur. L’hydratation cutanée peut aussi être mesurée.
• L’impact esthétique est évalué au moyen d’échelles : échelle de Vancouver et POSAS, préférentiellement.
• La gêne fonctionnelle est évaluée par une échelle EVA, les échelles de qualité de vie et de retentissement de la cicatrice sur la vie du patient.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :