Publié le 17 aoû 2008Lecture 9 min
Dépistage des lésions cutanées précancéreuses et biothérapie
M. BEYLOT-BARRY, service de dermatologie, hôpital Haut-Lévêque, CHU de Bordeaux
Des publications récentes ont pointé le rôle potentiel des biothérapies dans la survenue de cancers cutanés. Que faut-il en retenir ? Quelles sont les conséquences pratiques pour la mise en route d’une biothérapie ?
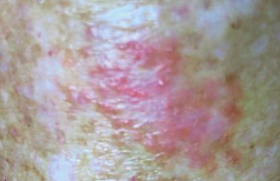
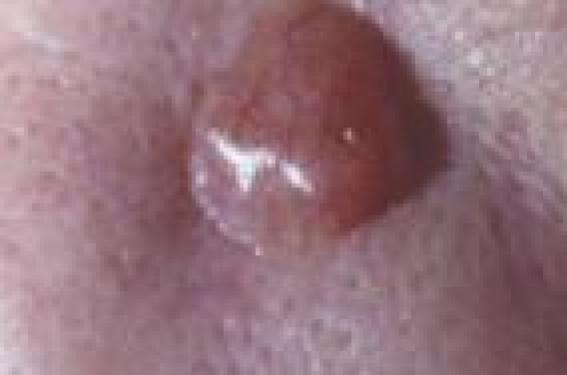
De quels cancers s’agit-il ? Les cancers cutanés sont des cancers très fréquents, accessibles à l’examen clinique. Ils ont comme principal facteur de risque l’exposition solaire et ce risque augmente en cas de phototype clair. Les cancers cutanés les plus fréquents sont les carcinomes basocellulaires au potentiel destructeur local (figure 1), devant les carcinomes spinocellulaires ou épidermoïdes (figure 2), au potentiel métastatique tardif. Ces derniers sont souvent précédés de lésions cutanées « précancéreuses », appelées kératoses actiniques (figure ), qu’il faut savoir reconnaître pour les traiter d’autant qu’elles constituent un marqueur de risque de cancers cutanés en général. Enfin, le mélanome (figure 4) est le cancer cutané le plus préoccupant par son potentiel métastatique et sa fréquence en augmentation. Figure 1. Carcinome basocellulaire. Figure 2. Carcinome spinocellulaire. Figure 3. Kératoses actiniques. Figure 4. Mélanome. On sait que le risque de développer un cancer cutané est très augmenté en cas d’immunodépression iatrogène comme cela a été montré chez les patients transplantés. La connaissance de ce risque est essentielle dans cette population où les cancers spinocellulaires, qui y sont les plus fréquents, ont une agressivité particulière avec une croissance rapide et un risque métastatique élevé. D’autre part, après un premier carcinome cutané, 100 % des greffés cardiaques et 80 % des greffés rénaux en développent un second dans les 5 ans. On sait que le risque de développer un cancer cutané est très augmenté en cas d’immunodépression iatrogène Biothérapie et risque de cancer Les premières publications sur cette question datent de 2005, avec notamment l’étude de Chakravarty et al.1 réalisée par questionnaire auprès de 15 789 patients ayant une polyarthrite rhumatoïde (PR) et de 3 639 autres présentant une ostéoarthrite. Ce travail avait conclu qu’il existait une discrète augmentation du risque de cancers cutanés (1,24) dans le groupe PR sous anti-TNF. D’autres auteurs comme Lebwohl et al. (2), qui ont comparé 1 442 patients atteints de PR inclus dans des essais cliniques avec l’étanercept (4 257 patients-année) et les données post-marketing de 125 000 PR sous étanercept avec celles du registre des cancers du Minnesota et de l’Arizona, n’ont à l’inverse pas trouvé d’augmentation d’incidence des cancers. C’est surtout le travail de T. Bongartz publié en 20063 qui a donné l’alerte quant à cerisque. Cette méta-analyse de 9 essais cliniques avec l’infliximab et l’adalimumab (3 493 patients traités, 1 512 sous placebo), a mis en évidence une augmentation du risque cancer sous anti-TNF avec un odds ratio (OR) à 3,3 (IC 95 % = 1,2-9,1). Ce risque augmentait à 4,3 en cas de dose élevée d’infliximab (> 6 mg/kg). Sur les 29 cancers observés dans le groupe traité (vs 3 dans le groupe placebo), 11 étaient des cancers cutanés, carcinomes basocellulaires, spinocellulaires et mélanome.Il n’existait pas d’accroissement du risque de cancers cutanés avec le temps, suggérant que les anti-TNF ont davantage un rôle de révélateur que d’inducteur des néoplasies cutanées. De nombreuses lettres ont été publiées en réponse à cette étude, avec des critiques concernant la méthodologie (analyse non ajustée à la durée d’exposition, groupes contrôles non appareillés, exclusion de certains essais et de l’étanercept, nombre de cancers dans le groupe placebo étonnamment bas, inférieur à celui attendu dans un groupe de PR). Parallèlement, les données publiées par la FDA pour l’infliximab, l’adalimumab et l’étanercept selon une méthodologie différente, ne montraient pas d’augmentation du risque de cancers. Enfin, F. Wolfe et son équipe4 ont étudié l’incidence des cancers dans une cohorte nordaméricaine de 13 001 PR suivies entre 1998-2005 (étude longitudinale, questionnaires bisannuels, 49 % sous traitements biologiques, infliximab, étanercept et adalimumab, durée moyenne de traitement de 3 ans, soit 49 000 patients-année) et l’ont comparée aux données du registre de surveillance national. Dans le groupe PR, 623 cancers cutanés ont été observés (13,4/1 000/an), dont 32 mélanomes (2,28/1 000/ an), soit un OR à 1,5 (p < 0,001) pour les cancers cutanés hors mélanomes, et à 2,4 (p = 0,005) pour les mélanomes. Par ailleurs, il n’a pas été constaté d’augmentation du risque des cancers autres que cutanés. À côté de ces études, des petites séries sont informatives par les histoires cliniques particulières qu’elles rapportent. Ainsi Smith et al. (5) ont décrit les cas de 7 patients traités par étanercept pour une PR qui ont présenté des carcinomes spinocellulaires de croissance rapide 2 à 4 mois suivant le début du traitement. Tous les patients avaient des altérations cutanées solaires importantes et 4 d’entre eux avaient des antécédents de carcinomes basocellulaires. Il faut souligner qu’aucun n’a développé un nouveau cancer cutané à un an, alors que l’étanercept était poursuivi. L’observation publiée par Esser et al.6 est également démonstrative : un malade ayant des antécédents de carcinomes cutanés multiples a été victime d’une recrudescence « éruptive » des carcinomes dans les 4 mois qui ont suivi le début du traitement par infliximab pour sa PR. Enfin Fulchiero et al.7 ont rapporté l’histoire de 2 pa-tients, qui 4 semaines après le début de l’étanercept et 6 mois après l’adalimumab, ont développé des métastases cutanées de leur mélanome, 6 ans et 8 ans après le diagnostic d’une lésion primitive. Les patients « à risque » de cancers cutanés Phototype clair (défini par la couleur de la peau, des yeux, des cheveux), l’existence d’éphélides, la réaction de la peau lors des expositions solaires (obtention d’un hâle ? coups de soleil ?) ; altérations cutanées liées au soleil (nombreux lentigos solaires, vieillissement cutané prématuré des zones exposées) ; nombreuses kératoses actiniques ; antécédents de cancers cutanés, donc à risque d’en développer de nouveaux. Que conclure de ces études ? Ces données suggèrent que les biothérapies ont un rôle davantage révélateur de tumeurs préexistantes ou de déclencheur de la transformation d’états précancéreux, plutôt que d’inducteur de cancers cutanés. Elles incitent toutefois à la prudence. Il faudra préciser si un type de cancer cutané est particulièrement concerné et si ces cancers ont une agressivité particulière (cela ne semble pas être le cas, mais les données actuelles sont insuffisamment informatives). Il faudra vérifier qu’il n’existe pas de risque cumulatif et préciser l’influence éventuelle des traitements antérieurs. Cela n’a pas été évalué dans la PR mais semble essentiel chez les patients psoriasiques traités par anti-TNF et ayant reçu de la photothérapie. Les biothérapies ont un rôle davantage révélateur de tumeurs préexistantes ou de déclencheur de la transformation d’états précancéreux, plutôt que d’inducteur de cancers cutanés. Quelle attitude pratique ? Avant la biothérapie Avant la mise en route d’un traitement par biothérapie, il faut identifier les sujets à risque de développer un cancer cutané et dans ce cadre, une consultation dermatologique initiale préthérapeutique semble souhaitable. Les lésions précancéreuses ou les cancers cutanés identifiés constituent-ils une contre-indication à la biothérapie ? En cas de kératoses actiniques, il faut les traiter selon les modalités habituelles (azote, traitements topiques : imiquimod, diclofénac, 5-fluorouracil, etc.) ; en cas d’antécédents de carcinomes basocellulaire ou spinocellulaire dont l’exérèse a été complète, il n’y a pas d’argument pour contre-indiquer une biothérapie. Ce ne serait qu’en cas de carcinome spinocellulaire avec une histologie très agressive (neurotropisme, carcinome indifférencié) que l’on pourrait discuter, au cas par cas, la mise en route de la biothérapie ; de la même manière, si lors de ce bilan, un carcinome basocellulaire ou spinocellulaire a été diagnostiqué, une fois son exérèse chirurgicale complète effectuée, la biothérapie peut être débutée ; en revanche, si l’examen met en évidence un mélanome ou s’il y a un antécédent de mélanome (sauf les mélanomes intra-épidermiques), même ancien, il paraît prudent, d’après les données actuelles, de considérer qu’il s’agit d’une contreindication en raison du risque de métastase tardive et de l’absence de traitement curatif du mélanome métastatique. Quelle surveillance dermatologique sous traitement ? Comme en cas d’immunodépression iatrogène, il est souhaitable de préconiser une photoprotection. Le rôle des biothérapies paraissant surtout révélateur, il faut surtout être vigilant au début du traitement. On pourrait préconiser un examen dermatologique tous les 3 mois la première année en cas de risque préexistant de cancer cutané (antécédent de cancer cutané, kératoses actiniques, phototype clair, surexposition solaire au cours de la vie) et tous les 6 mois en l’absence de terrain particulier. Ensuite, même en l’absence d’argument pour un risque cumulatif des biothérapies vis-àvis des cancers cutanés, il est raisonnable de réaliser une consultation dermatologique annuelle. Enfin, aucune donnée n’est disponible quant à l’intérêt d’un suivi après l’arrêt du traitement. Il paraît prudent de considérer que le mélanome est une contre-indication à un traitement par biothérapie. Points forts Les données actuelles concernant les biothérapies ne montrent ni un effet inducteur, ni un surrisque majeur de cancers cutanés mais sont plus en faveur d’un rôle révélateur de cancers cutanés sur un terrain préexistant. Beaucoup d’inconnues persistent mais il est important de sensibiliser les différents acteurs prenant en charge un traitement par anti-TNF. Il est prudent de mettre en place un suivi régulier et un recueil prospectif des cancers cutanés éventuellement observés.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :