Publié le 27 juin 2010Lecture 10 min
Traitement systémique du psoriasis : recommandations européennes
D. FARHI, Paris
Il existe d’importantes variations géographiques dans les modalités de prise en charge du psoriasis. Ceci est en grande partie lié à l’absence de recommandations thérapeutiques internationales jusqu’à récemment. Des recommandations européennes pour la prise en charge du psoriasis ont été publiées fin 2009 dans le JEADV. L’objectif était de fournir aux praticiens une synthèse pragmatique et actualisée des données d’efficacité et de tolérance disponibles sur les traitements systémiques du psoriasis.
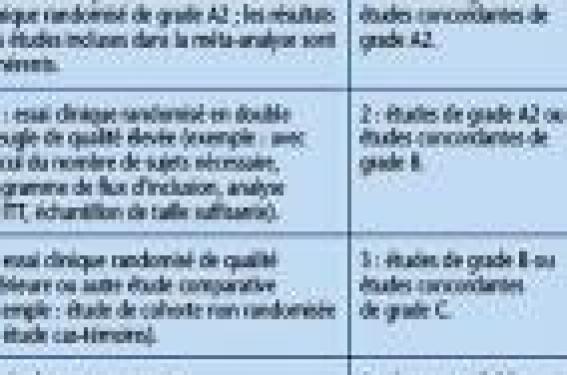
Méthodes Critères d’évaluation de la réponse aux traitements • Le PASI (Psoriasis Area and Severity Index) a été retenu comme critère de jugement principal de l’efficacité, dans l’évaluation par l’investigateur. Le PASI est loin d’être un outil métrologique idéal, mais il a l’avantage d’avoir été largement utilisé depuis 1978, ce qui permet – avec les limites méthodologiques que cela comporte toujours – de confronter les résultats des différents essais publiés. Une réponse PASI 75 a été définie comme objectif thérapeutique de référence. • Le DLQI (Dermatology Life Quality Index) est l’échelle de qualité de vie la plus utilisée dans le psoriasis et a été retenu comme critère de jugement principal de l’efficacité, dans l’évaluation par le patient. Un DLQI de 0 ou 1 a été défini comme objectif thérapeutique par ces recommandations. Sources La recherche documentaire incluait : – d’une part, les recommandations nationales existantes, notamment britanniques, hollandaises et allemandes ; – d’autre part, une recherche bibliographique conduite jusqu’au 16 octobre 2007. Les traitements systémiques inclus dans la recherche bibliographique comprenaient l’acitrétine, le méthotrexate, la ciclosporine, l’acide fumarique, l’adalimumab, l’infliximab, l’étanercept, l’aléfacept et l’éfalizumab. L’ustékinumab n’était pas pris en compte dans cette évaluation. Cette recherche permettait d’identifier 678 études, dont 114 remplissaient les critères d’inclusion dans ces recommandations. Tableau 1. Grades des études et niveaux de preuve des recommandations appliqués dans la conférence de consensus européenne. L’éfalizumab, retiré du marché début 2009, est exclu de notre synthèse des recommandations européennes. Les grades de chaque étude et les niveaux de preuve de chaque recommandation appliqués dans cette conférence de consensus sont résumés dans le tableau 1. Critères de recommandation thérapeutique Un traitement était « recommandé », « suggéré » ou « non suggéré », respectivement, s’il était associé à une réponse PASI 75 chez plus de 60 %, 30- 60 % ou moins de 30 % des patients, après la phase d’induction (10 à 16 semaines). Synthèse des recommandations Méthotrexate Le méthotrexate a été évalué dans 6 essais cliniques, dont 3 l’évaluant en monothérapie (1 essai de grade A2 et 2 de grade C) et 3 en combinaison (1 essai de grade B et 2 de grade C). Une réponse thérapeutique accrue peut être obtenue en l’associant avec une photothérapie UVB ou PUVA (grade C). L’efficacité du méthotrexate s’installe lentement, mais augmente avec la durée de traitement (avis d’experts). Au total, le méthotrexate est recommandé dans le traitement au long cours du psoriasis. L’effet de l’adjonction de l’acide folique sur l’efficacité est controversé. Plusieurs études ont montré que l’acide folique était associé à une meilleure tolérance du méthotrexate. Ciclosporine La ciclosporine a été évaluée dans 17 essais cliniques, dont 15 en monothérapie : 2 essais de grade A2, 10 de grade B et 3 de grade C. Elle présente une efficacité marquée et rapide dans le psoriasis (niveau de preuve 1). La ciclosporine est suggérée pour un traitement à court terme (2 à 4 mois) des formes modérées à sévères de psoriasis, réfractaires aux traitements topiques et à la photothérapie. Moins souvent, la ciclosporine peut être envisagée pendant 1 à 2 ans sous réserve d’un suivi rigoureux de la toxicité (en particulier vis-à-vis de la fonction rénale). La forme micro-émulsionnée (Néoral®) présente une meilleure biodisponibilité que la forme historique (Sandimmun®). Rétinoïdes L’étrétinate (Tigason®), l’acitrétine (Néotigason®, Soriatane®) et l’isotrétinoïne (Roaccutane®) sont utilisés depuis plus de 3 décennies dans le psoriasis, mais seuls l’étrétinate et l’acitrétine ont eu l’AMM dans le psoriasis. La première publication rapportant l’utilisation de l’étrétinate dans le psoriasis date de 1975. La première publication évaluant l’acitrétine date de 1984. Seule l’acitrétine est commercialisée dans cette indication dans la plupart des pays d’Europe. Malgré les 7 essais cliniques publiés, il est difficile d’estimer de façon fiable l’efficacité des rétinoïdes (niveau 3). L’expérience clinique suggère l’efficacité de l’association des rétinoïdes avec le calcipotriol ou la photothérapie (avis d’experts). L’acitrétine en monothérapie n’est pas recommandée en 1re intention. L’utilisation de l’acitrétine est fortement déconseillée chez la femme en âge de procréer. Tableau 2. Traitements systémiques oraux (dits « conventionnels » ou « classiques ») du psoriasis. Tableau de synthèse. Esters d’acide fumarique L’efficacité des fumarates dans le psoriasis est connue depuis 1959. Les spécialités Fumaderm initial® et Fumaderm® contiennent du diméthyl fumarate (DMF, principal ingrédient actif) et 3 sels d’éthyl-hydrogène fumarate, et ne diffèrent que par la quantité de DMF (respectivement 30 et 120 mg par comprimé). Actuellement, seul Fumaderm® est commercialisé. Le DMF est rapidement métabolisé en monométhyl fumarate (MMF). Les fumarates induisent la réduction du glutathion et entraînent une diminution de la translocation du facteur nucléaire kappa B (NF-ΚB) du cytosol vers le noyau. Ainsi, la transcription par le NF-B de médiateurs inflammatoires (TNFα, IL-8) et de molécules d’adhésion intercellulaire (E-sélectine, ICAM1, VCAM1) est inhibée. Les fumarates inhibent également la maturation des cellules dendritiques et favorisent la sécrétion de cytokines de type Th2 (plutôt que Th1). Enfin, les fumarates induisent l’apoptose, notamment des cellules T activées. Au total, 9 essais cliniques ont évalué les fumarates : 2 essais de grade A2, 2 de grade B et 5 de grade C (niveau de preuve 2, en raison de l’hétérogénéité des résultats). L’amélioration est généralement visible à partir de 6 à 8 semaines de traitement. La tolérance à court terme est principalement limitée par les troubles digestifs (jusqu’à 60 % des patients) et les flushs. La tolérance à long terme est bonne et il n’y a pas de sur-risque de maladie opportuniste ou de cancer. Les fumarates peuvent être associés aux traitements topiques (notamment le calcipotriol) et à la photothérapie. L’acide fumarique est un traitement suggéré par ces recommandations en traitement d’attaque et au long cours chez des patients adultes présentant un psoriasis modéré à sévère. Adalimumab L’adalimumab est un anticorps anti-TNFα monoclonal recombinant contenant des séquences peptidiques humaines. Il a montré son efficacité dans 2 essais de grade A2 (niveau de preuve 1). Le PASI 75 était atteint à la 16e semaine par 53 et 80 % des patients, respectivement ; le PASI 100 était atteint par environ 14 % des patients (tableau 3) Tableau 3. Biothérapies ayant l’AMM dans le psoriasis. Tableau de synthèse. Les effets indésirables les plus fréquents étaient les réactions au site d’injection, les infections respiratoires supérieures, les céphalées, les éruptions cutanées et les sinusites. Des infections graves ont été rapportées. Au total, l’adalimumab est recommandé en traitement d’induction pour le psoriasis modéré à sévère en cas de non-réponse, contre-indication ou intolérance de la photothérapie et des traitements systémiques conventionnels. Étanercept L’étanercept est un dimère protéique d’origine humaine, formé de la fusion du domaine extracellulaire du récepteur au TNF et du fragment Fc de l’IgG1. Sur 8 essais ayant évalué l’étanercept en monothérapie, 4 étaient de grade A2, 3 de grade B et 1 de grade C (niveau de preuve 1). Le délai de rechute (perte de 50 % de l’amélioration du PASI) est de 70 à 90 jours. L’effet indésirable le plus fréquent est la réaction au site d’injection. La tolérance à long terme est mal documentée. Au total, l’étanercept est suggéré en traitement d’induction pour le psoriasis modéré à sévère en cas de non-réponse, contre-indication ou intolérance de la photothérapie et des traitements systémiques conventionnels. Infliximab Sur 6 essais cliniques ayant évalué l’efficacité de l’infliximab dans le psoriasis, 3 étaient de grade A2, 1 de grade B et 2 de grade C (niveau de preuve 1). Son avantage est son efficacité rapide et marquée. Environ 80 % des patients atteignent le PASI 75 et plus de 50 % atteignent le PASI 90 à la semaine 10. La majorité maintient la réponse thérapeutique au moins 1 an. Chez environ 10 à 20 % des patients, la réponse initiale est perdue. Chez ces patients, l’association infliximab-méthotrexate pourrait être bénéfique (avis d’experts). Au total, l’infliximab est recommandé en traitement d’induction pour le psoriasis modéré à sévère en cas de non-réponse, contre-indication ou intolérance de la photothérapie et des traitements systémiques conventionnels. Aléfacept L’aléfacept est un anticorps IgG1 anti-LFA-3 d’origine humaine. L’aléfacept fut la première biothérapie ayant eu l’AMM pour le psoriasis aux États-Unis, mais en dehors de la Suisse, il n’a pas obtenu l’AMM en Europe. Son mécanisme d’action implique, d’une part, une inhibition de l’activation des lymphocytes T par blocage du récepteur CD2 (sur lequel LFA-3 ne peut alors plus se fixer) et, d’autre part, l’induction de l’apoptose des lymphocytes T. L’aléfacept a été évalué dans 6 essais cliniques, dont 2 études pivotales de phase III incluant au total 1 060 patients (niveau de preuve 1). L’aléfacept n’est pas recommandé en première intention parmi les biothérapies du psoriasis. Photothérapie La photothérapie est utilisée dans le psoriasis (tableau 4) depuis plus de 50 ans. Tableau 4. Photothérapie dans le psoriasis. Son efficacité repose sur un effet immunosuppresseur (mobilité réduite des cellules de Langerhans, inhibition de l’activation des cellules T et induction de l’apoptose des cellules T activées), sur une inhibition de l’hyperprolifération épidermique et sur un effet antiangiogénique. L’association des rétinoïdes avec la photothérapie permet d’augmenter l’efficacité et de diminuer les doses cumulées d’UV. • La photothérapie UVB à spectre étroit a été évaluée dans 8 essais de grade B (niveau de preuve 2), montrant un blanchiment du psoriasis dans 63 à 75 % des cas à 20 semaines. Dans la seule étude ayant évalué des séances quotidiennes, le blanchiment était obtenu pour 86 % des patients en 4 semaines. • La PUVAthérapie a été évaluée dans 20 essais, dont 2 de grade A2, 17 de grade B et 1 de grade C (niveau de preuve 2). Dans 2 essais comparant le 5-MOP et le 8-MOP, le 8-MOP était supérieur en efficacité. En raison du risque de cancers cutanés, il est recommandé de ne pas dépasser la dose cumulée de 1 000 J/cm2 au cours de la vie. Au total, la photothérapie est recommandée dans le traitement d’induction, mais pas pour le traitement à long terme, car peu pratique et associée à des effets indésirables dose-dépendants (augmentant avec le nombre de séances). Les UVB à spectre étroit sont recommandés en 1re intention. La PUVA doit être réservée aux échecs des UVB. Conclusion Les recommandations européennes représentent une synthèse précieuse pour la prise en charge quotidienne des psoriasis modérés à sévères par traitements systémiques. Elles ont également le mérite d’éclairer les zones à défricher, notamment dans le cadre des biothérapies : la tolérance à long terme, les modalités optimales du traitement d’entretien et les combinaisons thérapeutiques potentiellement bénéfiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :