Maladie de système, Médecine interne
Publié le 13 nov 2024Lecture 5 min
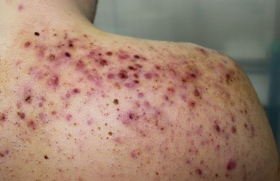
Les biothérapies dans l’hidradénite suppurée
Catherine FABER, Saint Mandé

Les résultats d’études sur les biothérapies dans l’hidradénite suppurée ont fait l’objet d’un grand nombre de communications. Nous en proposons ici un compte rendu non exhaustif.
Deux analyses post hoc des données poolées des études pivotales de phase III SUNSHINE et SUNRISE du sécukinumab versus placebo (n = 1 084 patients) ont été présentées.
La première concerne l’efficacité du traitement mesurée par l’IHS4 (International Hidradenitis Suppurativa Severity Scoring System)(1). Pour mémoire, ce score se compose du nombre de nodules inflammatoires, d’abcès et de fistules drainantes. Par comparaison au placebo, le sécukinumab aux deux posologies testées (300 mg S/C toutes les 2 ou 4 semaines [SECQ2W et SECQ4W]) a amélioré significativement la réponse au traitement évaluée par l’IHS4-55 (55 % d’amélioration du score IHS4 initial) ainsi que la sévérité de la maladie. Cette efficacité observée à la 16e semaine s’est maintenue jusqu’à la 52e semaine. L’IHS4-55 apparaît donc comme un outil fiable d’évaluation de l’efficacité du traitement de l’HS, seul ou en association avec le score HiSCR (Hidradenitis Suppurativa Clinical Response).
La seconde analyse post hoc porte sur les arrêts de traitement chez les patients qui ont subi une intervention chirurgicale au cours des essais(2). Ce cas de figure a été moins fréquent dans le groupe sécukinumab (SECQ2W : 3,6 % ; SECQ4W : 3,3 %) que dans le groupe placebo (6,6 %). À S16, l’incidence des chirurgies, pour HS ou non, avec arrêt du traitement par sécukinumab était ≤ 0,6 % dans tous les groupes de traitement. À S52, 16,5 % des patients avaient été opérés au moins une fois, dont la moitié pour HS. Toutes chirurgies confondues, seulement 1,1 % et 0,8 % des patients (SECQ2W et SECQ4W) avaient arrêté le sécukinumab (respectivement 0,3 % et 0,6 % en cas de chirurgie HS et non-HS). Dans les bras placebo, l’incidence des arrêts de traitement était ≤ 2,3 %. Enfin, les patients ayant poursuivi la biothérapie n’ont pas présenté de surrisque d’infection dans les 30 premiers jours post-chirurgie.
Des facteurs prédictifs de rémission sous adalimumab, l’autre biothérapie disposant d’une AMM dans l’HS modérée à sévère, ont été recherchés dans une étude observationnelle rétrospective sur 8 ans (1er mai 2015-31 octobre 2023)(3). Elle a inclus 540 patients traités par ce médicament, pour lesquels le temps de survie globale a été en moyenne de 56 mois. Il s’agissait d’une cohorte multicentrique caractérisée par un ratio de sexe aux alentours de 1 (50,1 % de femmes) et, au début du traitement, par un âge médian de 43,5 ± 1 an et un IMC médian de 29,5 ± 6,7. Un délai plus court entre le diagnostic et le début du traitement (HR : 2,16) et un score IHS4 initial plus faible (HR : 1,92) sont apparus comme les deux facteurs prédictifs significatifs d’une rémission clinique. Une étude, elle aussi multicentrique rétrospective mais en vie réelle, a évalué l’efficacité, la sécurité et les doses de l’adalimumab chez 55 adolescents atteints d’HS, dont 37 de sexe masculin, âgés en moyenne de 15,93 ± 1,9 an au début de la maladie, et un score IHS4 de 17,07 ± 7,89(4). L’adalimumab est à ce jour la seule biothérapie autorisée dans cette population de patients (à partir de 12 ans, aux mêmes posologies que chez l’adulte) pour laquelle, toutefois, il n’existe pas d’essai clinique. Les données sur le sujet proviennent uniquement de publications isolées. Dans cette étude dite ADOLESBIOHS, une rémission clinique (HiSCR) a été observée chez 77 % des patients à 6 mois avec une amélioration de la sévérité de la maladie (IHS4 : 6,09 ± 4,70). Des études prospectives à long terme sont nécessaires pour confirmer ces résultats.
Plusieurs volets des résultats des essais de phase III BE HEARD I et Il (n = 1 104 patients, schémas posologiques Q2W/Q4W) ont été rapportés. Ces analyses des données poolées des essais ou post hoc concernent l’efficacité du bimékizumab versus placebo sur différents critères analysés séparément : l’évolution du score IHS4, la réponse IHS4- 55/IHS4-90, les lésions, la qualité de vie et le moment de l’initiation du traitement par rapport au diagnostic de l’HS. L’amélioration des catégories de sévérité (IHS4) mise en évidence à S16 chez les patients sous biothérapie s’est maintenue dans le temps(5). À S48, 37,3-40,1 % avaient une HS légère (0,3 % à l’inclusion), 23,8-25,3 % une HS modérée (11,6-16,3 %) et 34,7-39 % une HS sévère (83,7-88,4 %). Une réduction du score de sévérité a aussi été observée chez les patients des groupes placebo qui ont été mis sous bimékizumab à S16.
Les résultats en termes de réponse IHS4-55 et IHS4-90 sont également positifs en faveur de la biothérapie, avec un maintien ou une augmentation du taux de patients ayant atteint ces objectifs à S48(6).
Même constat pour le bénéfice du traitement par bimékizumab sur le nombre de lésions et sur sa réduction en valeur absolue ou en pourcentage, qui s’est traduit par une amélioration de tous les types de lésions et dans les différents sites anatomiques(7). Par ailleurs, l’amélioration de la qualité de vie, évaluée par le questionnaire HiSQOL, est d’autant plus importante que le niveau de réponse clinique est élevé(8). Parmi les patients sous bimékizumab, 69,5-74,8 % (Q2W/Q4W) de ceux qui avaient atteint l’IHS4-55 à S16 avaient un score HiSQOL ≤ 14 (pas ou peu d’impact sur la QDV), 77,2- 84,3 % pour l’IHS4-75 et 80- 89,3 % pour l’IHS4-90. La même tendance a été observée à S48. Enfin, si le bimékizumab est efficace quelle que soit la durée de l’HS, le taux de réponse clinique est plus élevé en cas d’initiation du traitement plus précoce(9). Dans le groupe des patients traités moins de 2,4 ans après le diagnostic de l’HS, 84,5 et 80,8 % (Q2W et Q4W) avaient atteint un IHS4-55 et 73,1-67,1 % un IHS4-75. Quand la durée de la maladie était de plus de 10 ans au début du traitement, leur proportion était de, respectivement, 69,9-60 % et 54,3-52,2 %.
Le sonélokimab est actuellement en phase II de développement clinique pour le traitement de l’HS. Dans l’étude MIRA menée chez 67 patients adultes pendant 12 semaines, cette molécule s’est montrée significativement supérieure au placebo pour améliorer la sévérité de la maladie (IHS4)(10) ainsi que la douleur et la QDV(11). Ces résultats prometteurs justifient le passage à la phase III.
13th Conference of the European Hidradenitis Suppurativa Foundation – EHSF 2024.
Compte rendu réalisé à partir des abstracts.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :