Publié le 28 sep 2020Lecture 2 min
Dermatite atopique : le dupilumab fait ses preuves chez les enfants à partir de 6 ans
C. FABER, Paris
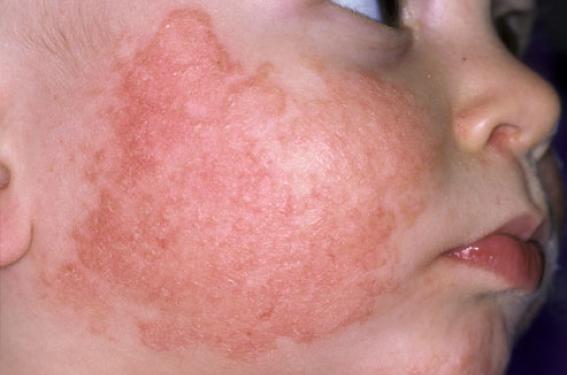
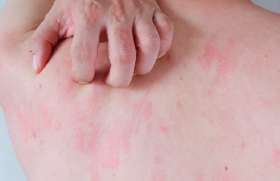
Le dupilumab est actuellement autorisé comme traitement de la dermatite atopique (DA) modérée à sévère chez les adultes et les adolescents à partir de 12 ans. L’étude de phase 3 LIBERTY AD PEDS démontre son intérêt chez les enfants de 6 ans à 12 ans.
Cette étude randomisée contrôlée contre placebo a été réalisée en Amérique du Nord et en Europe. Elle a évalué l’efficacité et la tolérance du dupilumab (un anti-IL-4/IL-23) en association avec des dermocorticoïdes (DC) chez 367 enfants âgés en moyenne de 8,5 ans et dont la maladie évoluait moyenne depuis 7,2-7,4 ans. Ils ont été affectés par randomisation dans trois bras : dupilumab + DC 300 mg toutes les 4 semaines (n = 122 patients) ; dupilumab + DC toutes les 2 semaines à raison de 100 mg pour les moins de 30kg et 200mg pour ceux de poids ≥ 30 kg (n = 122) ; placebo + DC (n = 123). Après une période de traitement de 16 semaines, l’étude s’est poursuivie en ouvert jusqu’à 28 semaines.
Le traitement par dupilumab + DC a entrainé une amélioration clinique significative, comme l’attestent les résultats sur les deux cocritères de jugement principaux. Dans la population globale de l’étude, respectivement 30 % et 33 % des patients traités par les schémas /2 semaines et /4 semaines avaient un score IGA 0/1 (blanchiment ou quasi blanchiment) à 16 semaine versus 11 % sous placebo. Une amélioration de 75 % du score EASI a été obtenue chez, respectivement, 67%, 70% et 27% des patients. Pour le prurit, la différence entre les groupes traitement actif et placebo est également significative : 60 % et 68 % ont eu une amélioration d’au moins 3 points sur l’échelle d’évaluation numérique du prurit (Peak Pruritus Numerical Rating Scale) versus 25 % dans le groupe placebo. Des différences ont été constatées entre les groupes en fonction du poids. Chez les enfants de moins de 30 kg, le dupilumab 300 mg/4 semaines a donné meilleurs résultats que l’administration de 100 mg toutes les 2 semaines à la fois sur l’IGA 0/1 et l’EASI-75.
Le dupilumab a été bien toléré et aucun signal d’alerte n’est apparu. Les effets indésirables sévères étaient rares (1,7 % placebo et dupilumab/4 semaines, aucun avec le schéma /2 semaines) et seulement 2 arrêts de traitement ont été rapportés dans les groupes placebo et dupilumab/2 semaines. Les réactions au site d’injection et les conjonctivites étaient plus fréquentes qu’avec placebo. Le profil de tolérance satisfaisant du dupilumab chez les enfants âgés de 6 à moins de 12 ans mis en évidence dans cette étude est cohérent avec les données observées chez l’adolescent et l’adulte.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :