Publié le 28 sep 2020Lecture 3 min
Dermatite atopique : résultats de phase 3 positifs pour le tralokinumab
C. FABER, Paris
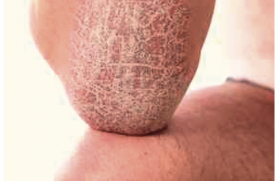
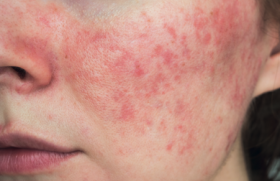
Les résultats de trois études de phase 3 sur le tralokinumab dans la dermatite atopique modérée à sévère de l’adulte sont concluants. Cet anticorps monoclonal anti-IL-13 a donné des résultats significativement supérieurs à ceux du placebo sur tous les critères de jugement.
Pour les trois études —ECZTRA1,2 et 3 —, les critères de jugement principaux étaient la réponse IGA (Investigator’s Global Assessment) 0/1 et l’amélioration de 75 % du score EASI (Eczema Area and Severity Index score ; EASI-75) à la semaine 16. Les critères secondaires ont inclus l’étendue et la gravité des lésions cutanées (SCORAD : SCORing Atopic Dermatitis), l’importance du prurit (NRS : Pruritus Numeric Rating Scale) et la qualité de vie (DLQI : Dermatology Life Quality Index).
En monothérapie
ECZTRA 1 et 2 sont des études identiques, globales, menées sur respectivement 802 et 794 patients atteints d’une DA qui était sévère dans 50,7 % et 48,7 % des cas. Le tralokinumab a été administré à la dose de 300 mg S/C toutes les 2 semaines pendant 16 semaines. Après cette période initiale de traitement, les patients ont fait l’objet d’une nouvelle randomisation. Les répondeurs, d’une part, ont été répartis en trois bras : tralokinumab toutes les 2 ou 4 semaines ou placebo, pour une durée supplémentaire de 36 semaines. Les non répondeurs, d’autre part, ont été affectés à une étude ouverte tralokinumab/2 semaines + dermocorticoïdes (DC) en option ou placebo.
À S16, les résultats étaient en faveur du tralokinumab avec un taux de réponse IGA 0/1 de 15,8 % (ECZTRA 1) et 22,2 % (ECZTRA 2) versus 7,1 % et 10,9 % sous placebo, et un EASI-75 atteint par 25 % et 33,2 % des patients versus 12,7 % et 11,4 %. Un nombre significativement supérieur de patients a également eu des résultats positifs significatifs en termes de prurit (20 %/26 % vs 10,3 %/8,6 %), de SCORAD et de qualité de vie. La réponse clinique s’est maintenue de façon significative jusqu’à la semaine 52 chez la majorité des patients traités par tralokinumab/2 semaines : 51,3 % et 59,3 % dans les deux études pour le score IGA 0/1 et 59,6 % et 55,8 % pour l’EASI-75. Avec le schéma posologique/4 semaines, c’était le cas dans, respectivement, 38,9 %/44,9 % et 49 %/51 % des cas. Enfin, l’étude ouverte a montré que la poursuite du traitement par tralokinumab et DC optionnels permet d’améliorer certains patients initialement non répondeurs. À S52, 50,4 %/42,3 % avaient en effet atteint un EASI-75 et 2›4,3 %/22,5 % un score IGA 0/1.
En combinaison avec les dermacorticoïdes
Dans l’étude ECZTRA 3, les 380 patients, dont 46,3 % avec une DA sévère, ont été randomisés en deux groupes : tralokinumab 300 mg/2 semaines + DC (classe 3) et placebo + DC. Sa méthodologie prévoyait aussi une nouvelle randomisation des patients à S16, pour 16 semaines de plus. Avec la combinaison anti-IL-13 et DC, le taux de réponse clinique à S16 était de 38,9 % et 56 % pour l’IGA 0/1 et l’EASI-75 versus 26,2 % et 35,7 % dans le groupe contrôle. Ce traitement est également associé à l’utilisation d’une plus faible dose cumulative de DC (134,8 g vs 183,5 g). Tous les critères secondaires se sont significativement améliorés, qu’il s’agisse du prurit (45,4 % des patients vs 34,1 %), du SCORAD ou du DLQI (11,7 vs -8,8). Près d’un tiers des patients affichaient un score EASI-90 à S16 (32,8 % vs 21,4 %). À 32 semaines, les bénéfices cliniques perduraient chez la grande majorité des répondeurs : 89,6 % (IGA 0/1) et 92,5 % (EASI-75) avec le schéma tralokinumab/2 semaines et 77,6 % et 90,8 % sous tralokinumab/4 semaines. Parmi les non répondeurs, 30,5 % et 55,8 % avaient atteint ces deux critères.
Dans les trois études, le tralokinumab a montré un profil de tolérance favorable, sans différence significative avec le placebo de la fréquence globale et de la sévérité des effets indésirables (EI) y compris lors de la prolongation du traitement. Les EI les plus fréquents étaient les infections respiratoires hautes (10 % à 23 % selon les études vs 11 % à 21 % sous placebo) et les conjonctivites (7 % et 3 % dans ECZTRA 1 et 2 vs 2 % ; 11 % dans ECZTRA 3 vs 3 %). Dans l’étude sur la combinaison tralokinumab + DC, il y a eu moins d’infections sévères et d’eczéma herpeticum que dans le groupe contrôle.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :