Publié le 16 déc 2008Lecture 13 min
Les condylomes : comment en venir à bout !
F. AUBIN, Laboratoire de biologie cellulaire, Université de Franche-Comté
L’infection génitale par les papillomavirus humains (HPV) est l’une des infections sexuellement transmissibles les plus fréquentes(1,2). Les lésions qui en résultent, les condylomes, ont une contagiosité et une dangerosité qui dépendent du type d’HPV. La prévention, avec depuis peu la vaccination, et la surveillance permettront-elles de diminuer l’épidémie ?
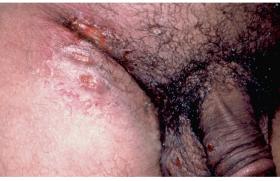
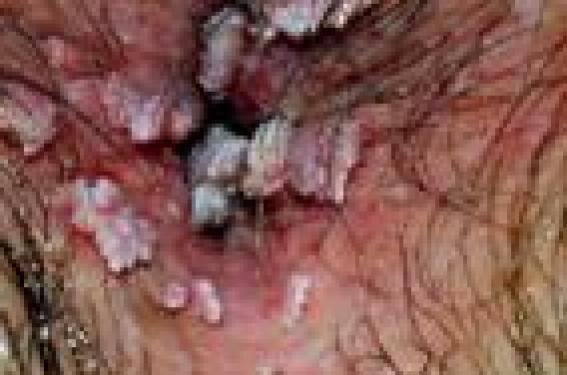
Épidémiologie L’infection à HPV est le plus souvent asymptomatique et synonyme d’activité sexuelle, en particulier chez la jeune femme. Quatre-vingts pour cent des adultes âgés de 50 ans ont été en contact avec des HPV et 1 % des femmes ou hommes vont présenter des condylomes. Les cellules cibles des HPV étant les cellules épithéliales basales, leur infection est possible grâce à des microtraumatismes de contact. L’infection génitale a le plus souvent lieu au début de l’activité sexuelle. Les porteurs sains d’HPV représentent environ 20 % des hommes de moins de 25 ans (3,4) et 25 à 40 % des femmes de moins de 25 ans. Lorsque l’infection est productive, la charge virale des HPV muqueux peut être très élevée au niveau des lésions génitales facilitant ainsi leur transmission. Le risque de transmission après un contact sexuel infectant est de 60 à 70 %, avec un risque plus important de la femme vers l’homme (50 à 90 %) que dans le sens inverse (50 %). La durée d’incubation des HPV avant le développement de condylomes acuminés est d’environ 3 à 6 mois, mais le virus peut rester à l’état latent pendant plusieurs mois voire des années. Des lésions cliniques génitales sont observées chez environ un tiers des partenaires de femmes présentant des condylomes acuminés. Inversement, la présence de lésions péniennes et/ou de portage de HPV apparaît élevée chez les hommes partenaires de femmes ayant des lésions à HPV génitales. Bien qu’appartenant au genre alpha, les génotypes des HPV détectés au niveau du pénis et du col utérin ne sont pas toujours identiques. Au niveau génital, on distingue les HPV à bas risque (types 6 et 11) qui sont responsables de lésions bénignes de type condylomes acuminés et les HPV à haut risque (types 16 et 18) responsables de lésions dysplasiques de grade et de sévérité croissants puis de cancers. Les lésions précancéreuses ou cancéreuses associées aux HPV à haut risque sont peu contagieuses du fait de l’intégration génomique et de la faible production virale alors que les lésions bénignes associées à une charge virale élevée sont très contagieuses. Les lésions précancéreuses ou cancéreuses associées aux HPV à haut risque sont moins contagieuses que les lésions bénignes. Évolution spontanée d’une infection à HPV L’infection à HPV est le plus souvent éliminée avant même l’apparition de lésions. Le plus souvent, l’infection génitale ou cutanée à HPV se résout spontanément grâce à la mise en place d’une réponse immunitaire efficace (5,6). Les premières lignes de défenses immunitaires sont constituées par les réponses innées qui sont peu spécifiques de l’agent pathogène. Les relais de cette réponse sont constitués de cellules sentinelles comme les cellules épithéliales elles-mêmes, les cellules dendritiques ou les cellules de Langerhans, ou encore des cellules effectrices (monocytes, macrophages, cellules Natural Killer) qui évoluent dans un environnement de cytokines qui peuvent avoir des propriétés antivirales. La clairance virale s’effectue en moyenne en 12 mois avec une plus grande rapidité au niveau génital pour les femmes jeunes. Toutefois, la clairance virale est parfois incomplète et il peut persister une infection latente qui, sous l’influence de certains facteur (immunodépression dans le cadre d’une greffe d’organe, ou infection par le VIH), peut évoluer à nouveau vers une infection productive. En particulier, le génotype 16 possède une capacité de persistance plus importante que les autres génotypes, observation cohérente avec le fait que ce HPV présenterait un avantage sélectif expliquant sa forte prévalence dans le monde entier. Le génotype 16 possède une capacité de persistance plus importante que les autres. Aspects cliniques On distingue les condylomes acuminés (figures 1 et 2) exophytiques, les condylomes plans, et les condylomes géants ou tumeur de Buschke-Lowenstein (figure 3) qui sont principalement infectés par les HPV 6 et 11. Figures 1 et 2. Condylomes acuminés. Figure 3. Condylomes géants ou tumeur de Buschke-Lowenstein. La papulose bowénoïde (figure 4) qui prend l’aspect de maculo-papules pigmentées est une lésion à haut risque de dégénérescence vers une maladie de Bowen (figure 5) (érythroplasie de Queyrat chez l’homme) en raison de son infection par l’HPV 16 à haut risque oncogène. La transformation en carcinome épidermoïde est alors possible (figure 6). Figure 4. Papulose bowénoïde.Figure 5. Maladie de Bowen.Figure 6. Carcinome épidermoïde. Diagnostic d’une infection à HPV Il s’agit d’un diagnostic clinique et la confirmation de la présence d’HPV n’est pas nécessaire. L’application d’acide acétique à 5 % permet d’accentuer la visibilité des condylomes qui vont prendre un aspect blanchâtre (figure 7). Cet aspect peut être trompeur avec une cicatrice induite par un traitement destructeur. Cependant, en cas de doute diagnostique ou de suspicion de transformation néoplasique d’une lésion cutanée ou muqueuse, une biopsie est nécessaire. L’examen histologique retrouve des signes d’infection par HPV induits par l’effet cytopathogène caractéristiques du virus (figure 8). Figure 7. Condylomes plans après application d’acide acétique. Figure 8. Aspects histologiques de koïlocytes. Les cellules épithéliales infectées prennent un aspect ballonisé et vacuolisé avec un noyau hyperchromatique (koïlocytes). Le diagnostic virologique repose sur l’analyse de l’ADN viral par des techniques de biologie moléculaire (figure 9). Il est essentiellement utilisé pour mettre en évidence la présence d’HPV à haut risque oncogène de type 16 ou 18. Les techniques moléculaires disponibles pour la détection des HPV reposent toutes sur l’hybridation de séquences d’ADN viral avec des sondes oligonucléotidiques spécifiques. Les deux techniques de référence pour la détection de l’ADN des HPV sont aujourd’hui la capture d’hybrides et les méthodes de PCR pour le génotypage. Le diagnostic différentiel doit principalement éliminer la couronne perlée (figure 10), et les syphilides papuleuses. Enfin, de façon systématique, la recherche d’autres maladies sexuellement transmissibles asymptomatiques doit être effectuée (encadré). Maladies sexuellement transmissibles à dépister chez les patients asymptomatiques porteurs de condylomes ano-génitaux • Sérologie VIH • Sérologie VHB • TPHA-VDRL • PCR urinaire Chlamydia sur le jet d’urines, ou vulvovaginal chez les femmes • Frottis cervical avec typage HPV si possible (brosse Digène®) Condylomes chez les enfants (7,8) L’infection à HPV survient très tôt dans l’enfance et le plus souvent de façon transitoire en raison d’une réponse immunitaire efficace. Lorsque la mère est porteuse de HPV génitaux, la transmission mère-enfant est possible soit in utero à travers le placenta, soit au cours de l’accouchement. Mais elle est également possible plus tard au cours de l’enfance. Chez le nourrisson, l’infection orale à HPV de types 6 ou 11 est responsable de la papillomatose laryngée juvénile qui peut engager le pronostic vital. Alors que les condylomes de l’adulte représentent l’infection sexuellement transmissible la plus fréquente, la transmission sexuelle des condylomes ano-génitaux de l’enfant est très discutée. De plus, cliniquement, il n’est pas toujours facile de distinguer une localisation ano-génitale de verrues de véritables condylomes acuminés. Plusieurs études ont montré que les abus sexuels étaient impliqués dans 3 à 35 % des cas de condylomes ano-génitaux de l’enfant. La probabilité de maltraitance sexuelle augmente avec l’âge de l’enfant. Ainsi, la valeur prédictive positive des condylomes serait de 36 % entre 4 et 8 ans et de 70 % après 8 ans. La plupart des condylomes ano-génitaux de l’enfant témoigneraient donc d’une transmission non sexuelle, que ce soit par auto-inoculation, hétéroinoculation ou par l’intermédiaire d’objets infectés. C’est vrai en général, et ce d’autant plus que l’enfant est plus jeune. Figure 9. Diagnostic virologique. Hybridation in situ (HPV 16). Figure 10. Couronne perlée du gland. La plupart des condylomes ano-génitaux de l’enfant témoigneraient d’une transmission non sexuelle, et ce d’autant plus que l’enfant est plus jeune. Sur le plan pratique, il est donc recommandé de procéder à un examen complet de l’enfant à la recherche d’autres lésions cutanéomuqueuses d’infection à HPV et de lésions de maltraitance sexuelle. Un interrogatoire précis de l’enfant et de l’entourage s’efforcera de déterminer des arguments objectifs de maltraitance sexuelle. Une enquête médicosociale pourra être déclenchée. En cas de contexte socio-familial suspect, un examen des parents, des frères et soeurs et des personnes suspectes pourra être nécessaire pour rechercher des lésions cutanéo-muqueuses d’infection à HPV, en sachant que la découverte de condylomes chez un adulte proche ne sera jamais Un dépistage sérologique des autres infections sexuellement transmissibles sera réalisé. Enfin, dans certains cas, et seulement après concertation multidisciplinaire (pédiatres, PMI, assistante sociale, etc.) une déclaration au procureur de la République sera effectuée. Prévention (9) L’expérience acquise dans la prévention des autres infections sexuellement transmissibles a permis d’élaborer la stratégie ABC (Abstain, Be faithful, use Condom). Si l’efficacité des deux premières recommandations semble indiscutable, l’efficacité des préservatifs pour la prévention des infections à HPV est discutée. Leur intérêt est reconnu lorsque des lésions cliniques sont présentes mais ils ne protègent que la zone couverte. Enfin, dans le cadre de l’infection à HPV, l’intérêt de la circoncision reste très débattu. En présence de CIN ou de cancer du col, qui sont des lésions peu contagieuses, il est inutile de proposer un dépistage systématique du ou des partenaires en l’absence de lésion clinique, ni le port de préservatifs. L’intérêt des préservatifs est reconnu lorsque des lésions cliniques sont présentes, mais ils ne protègent que la zone couverte. Depuis fin 2006, un vaccin prophylactique anti-HPV (Gardasil®) est commercialisé pour la prévention des condylomes. Il s’agit d’un vaccin tétravalent ciblant les HPV à haut risque oncogène, 16 et 18, ainsi que les HPV à bas risque de types 6 et 11. L’efficacité préventive vis-à-vis des condylomes et des dysplasies cervicales est de l’ordre de 100 %. Sa tolérance est excellente et la protection induite par les anticorps neutralisants persiste au moins 7 ans. Le schéma de primovaccination comprend 3 doses de 0,5 ml administrées selon le schéma suivant : 0, 2 et 6 mois. Les dermatologues ont la possibilité de prescrire cette vaccination. Le remboursement par la Sécurité sociale est restreint aux indications suivantes : prévention des dysplasies de haut grade du col de l’utérus (CIN 2/3), des cancers du col de l’utérus, des dysplasies de haut grade de la vulve (VIN 2/3) et des verrues génitales externes (condylomes acuminés) dus aux papillomavirus humains de types 6, 11, 16 et 18, des jeunes filles âgées de 14 ans et des jeunes filles et jeunes femmes âgées de 15 à 23 ans qui n’auraient pas eu de rapports sexuels, ou au plus tard dans l’année suivant le début de leur vie sexuelle. Il n’est pas nécessaire de vérifier le portage HPV génital avant la vaccination. Traitement des condylomes (10) Le but du traitement est la destruction des lésions macroscopiques visibles. La régression spontanée des condylomes visibles est rare et l’évolution habituelle se fait vers l’extension des lésions en nombre et en taille responsables de gênes physiques. Aucune méthode thérapeutique ne permet l’éradication du virus, ce qui explique la fréquence des récidives, et ce d’autant plus que le virus peut persister en zone périlésionnelle. Enfin, aucune technique thérapeutique n’a fait la preuve de sa supériorité à long terme par rapport aux autres. Le taux de récidive est identique quelle que soit la méthode (environ 30 %), étant donné la possibilité d’infection virale asymptomatique. Les traitements disponibles sont longs, fastidieux, onéreux, contraignants et dans la plupart des cas douloureux pour le patient avec des taux de récidives élevés, à l’origine d’un fort retentissement psychologique et altération de la qualité de vie. Les patients doivent faire l’objet d’une surveillance clinique rigoureuse. Chez les patients immunodéprimés, les lésions cutanées et les lésions muqueuses à HPV doivent être éradiquées en raison du risque de transformation néoplasique favorisée par la co-infection par des HPV à haut risque oncogène. Une diminution du traitement immunosuppresseur peut être envisagé dans certaines situations. Le taux de récidive est identique quelle que soit la méthode de traitement (environ 30 %). Traitements destructeurs physiques Ces techniques sont souvent douloureuses et peuvent nécessiter une anesthésie locale (application de lidocaïne-pridocaïne et/ou injection sous-cutanée de xylocaïne). Cryothérapie En raison de sa facilité et de son faible coût, il s’agit du traitement le plus répandu. L’azote liquide est appliqué à l’aide d’un Coton- Tige en le maintenant sur la lésion, pendant 5 à 20 secondes. La pulvérisation d’azote en spray est une alternative. La cryothérapie peut être efficace en une seule séance, mais le plus souvent, en fonction des sites et de l’épaisseur, il faudra effectuer plusieurs applications. Curetage chirurgical Actuellement, la chirurgie est uniquement proposée pour une lésion unique volumineuse ou quelques lésions pédiculées. Vaporisation au laser CO2 Il s’agit d’une méthode coûteuse. La cicatrisation dure environ 3 à 6 semaines et 50 % des malades auront une cicatrice. Enfin, tant les lasers que l’électrocoagulation entraînent la formation de vapeurs qui sont potentiellement contaminantes (aérosol de particules virales). Il est donc nécessaire de posséder une aspiration efficace tandis que le malade et l’opérateur doivent avoir le visage (yeux, nez, bouche) protégé. Traitements destructeurs chimiques Podophylline Elle s’utilise en préparation magistrale, habituellement à une concentration variant entre 20 et 25 % de podophylline. La podophyllotoxine (commercialisé sous le nom de Condyline®) possède l’AMM pour le traitement des verrues génitales. Le produit est appliqué par le médecin sur la lésion et impérativement lavé après 6 heures maximum. Il faut habituellement répéter les applications une fois par semaine jusqu’à guérison. Les effets secondaires fréquemment observés sont liés à l’irritation, parfois sévère, survenant au site d’application. Le produit ne doit pas être utilisé chez la femme enceinte ou allaitante. Le 5-fluoro-uracile (Efudix®) en crème possède aussi l’AMM dans le traitement des condylomes. En raison de ses effets secondaires irritants, il s’utilise en général à raison de 2 à 3 applications successives hebdomadaires ou tous les 2 jours pendant plusieurs semaines. Traitements non destructeurs Des agents modulateurs de la différenciation kératinocytaire (rétinoïdes) et de la réponse immunitaire (imiquimod) ont été proposés dans le traitement des verrues. L’application d’acide rétinoïque en crème ou lotion est utilisée pour le traitement des verrues planes. L’imiquimod (Aldara® en crème à 5 %) est utilisé pour le traitement des condylomes à raison de 3 applications hebdomadaires pendant la nuit pour une durée maximale de 16 semaines. Il s’agit d’un ligand des récepteurs de l’immunité innée Toll-like de type 7 (TLR-7), dont la fixation entraîne une production de plusieurs cytokines, dont l’interféron- gamma (activité antivirale) et le facteur nécrosant des tumeurs (TNF-alpha, cytokine pro-inflammatoire). Son efficacité est d’environ 50-60 % avec un taux de récidive variant entre 15 et 20 %. Les effets secondaires sont liés à l’efficacité thérapeutique et comprennent une inflammation locale avec érythème et prurit, qui ne compromettent pas en général la poursuite du traitement. Enfin, dans tous les cas, étant donné la possibilité d’infection virale asymptomatique, les patients doivent faire l’objet d’une surveillance clinique rigoureuse.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :