Maladie de système, Médecine interne
Publié le 06 sep 2006Lecture 14 min
Lupus érythémateux disséminé : les enfants aussi !
M. Willems, B. Bader-meunier, Hôpital de Bicêtre, Le Kremlin-Bicêtre

Chez l’enfant, les manifestations cliniques initiales du lupus érythémateux disséminé (LED) sont polymorphes, parfois trompeuses, mais le diagnostic doit être évoqué chez une adolescente fébrile ayant une fièvre prolongée inexpliquée et une augmentation de la vitesse de sédimentation.
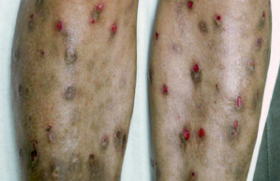
Le LED est une maladie systémique auto-immune d’étiologie inconnue, diagnostiqué avant l’âge de 16 ans dans 10 à 17 % des cas(1). La plupart des quelques séries pédiatriques publiées concluent qu’un LED à début pédiatrique est plus sévère qu’un LED commençant à l’âge adulte. Classification Les critères de classification de la maladie lupique actuellement retenus ont été établis et corrigés en 1982, puis remis à jour en 1997 par l’American Rheumatic Association (ARA). Après étude de dossiers de patients adultes, 11 critères ont été définis (tableau 1) et l’association d’au moins 4 d’entre eux est nécessaire pour inclure un patient dans une série de malades lupiques(2). Il s’agit donc bien de critères de classification, qui permettent d’étudier des groupes homogènes, et non de critères de diagnostic ; ils n’ont été validés chez l’enfant que dans une seule étude qui retrouve une sensibilité et une spécificité de 96 % et 100 % respectivement(3). Ils ne permettent pas toujours de distinguer un LED d’un syndrome primitif des anticorps antiphospholipides (SAPL). Même si moins de 4 critères sont présents, le diagnostic de LED peut être retenu si le tableau est très évocateur. Fréquence des cas pédiatriques Le LED à début pédiatrique est considéré comme une maladie rare, mais le diagnostic est porté avant l’âge de 16 ans dans 15 à 20 % des cas. « Près d’un patient lupique sur 5 a moins de 16 ans. » Incidence En France, la seule enquête épidémiologique concerne le lupus pédiatrique observé en région parisienne(4) et fait état d’une incidence de 0,22 cas pour 105 enfants (0,36 chez les filles et 0,08 chez les garçons). Le diagnostic est porté dans la majorité des cas après l’âge de 10 ans. Sex-ratio et variations ethniques Le sex-ratio fille/garçon semble moins élevé que chez l’adulte et varie considérablement d’une étude à l’autre de 5/1 à 18/1 ; il est plus faible avant la puberté qu’après. La fréquence de la maladie varie selon les ethnies, avec une fréquence plus grande chez les Noirs et les Asiatiques que chez les Blancs caucasiens. Le lupus induit est rare chez l’enfant La drogue la plus fréquemment incriminée chez l’adolescente est la minocycline. Citons également l’acébutolol, la quinidine, la chlorpromazine, la carbamazépine, l’interféron alpha et, récemment, les agents anti-TNF. Des manifestations initiales polymorphes La présentation initiale est parfois trompeuse. Dans l’étude rétrospective récente française de 155 enfants porteurs de LED, les atteintes cutanées, articulaires et hématologiques sont les plus fréquentes(5) (figure 1). chez 136 enfants de la cohorte française(5). L’atteinte rénale doit être systématiquement dépistée. Les atteintes cutanées Elles sont très diverses et se répartissent en atteintes spécifiques lupiques (figure 2) et en lésions non spécifiques, vasculaires ou autres (tableau 2)(6). Figure 2. Éruption lupique spécifique « en loup » du visage. Figure 3. Glomérulonéphrite lupique membrano-proliférative stade 4. Chez l’adulte ayant des lésions cutanées aiguës, l’immunofluorescence directe est positive dans 72 à 100 % des cas en peau malade et dans 50 % des cas en moyenne en zone saine non exposée ; des dépôts granuleux d’IgG, IgM et C3 sont alors présents à la jonction dermo-épidermique. La polyarticulopathie L’atteinte de l’appareil locomoteur se manifeste surtout par une atteinte polyarticulaire non érosive. Les articulations le plus souvent touchées sont, par ordre décroissant : les mains, les poignets, les genoux, les chevilles, les coudes et les épaules ; le rachis est en règle épargné. Les anomalies hématologiques Elles comportent la survenue de cytopénie(s) auto-immune(s). L’atteinte rénale Elle est présente chez 30 à 80 % des enfants, chez qui elle semble plus fréquente que chez l’adulte(7). La classification histologique de l’OMS en six stades, fondée sur les données en microscopie optique et en immunofluorescence, est la plus utilisée (tableau 3). Le premier symptôme est le plus souvent une protéinurie avec ou sans syndrome néphrotique. Une atteinte sévère de stade III ou IV est présente dès la première biopsie rénale chez plus de la moitié des enfants dans l’étude française(6). « Une protéinurie est souvent le premier symptôme. » La présence d’une HTA, ou d’une insuffisance rénale, ou d’une protéinurie importante, est évocatrice d’une atteinte sévère de type IV, mais il n’y a pas de corrélation anatomo-clinique absolue. La détection d’une anomalie du sédiment urinaire par une simple bandelette urinaire doit donc être systématique, et la réalisation d’une biopsie rénale doit être discutée avec une équipe spécialisée dès qu’il existe une protéinurie supérieure ou égale à 0,5 g/24 h et/ou une insuffisance rénale. Le pronostic est habituellement favorable dans les classes II, III avec moins de 20 % de glomérules atteints, et défavorables dans les autres cas de classe III et la classe IV (figure 3), mais il existe des formes de passage de l’une à l’autre classe. Figure 3. Glomérulonéphrite lupique membrano-proliférative stade 4. Manifestations neuropsychiatriques Présente dans environ un tiers des cas, elle comporte des manifestations très variées(8) : neuropathie périphérique, myélite transverse, névrite optique, et vascularite cérébrale diffuse ; la survenue d’accidents vasculaires cérébraux est corrélée avec la présence d’anticorps antiphospholipides. Le LCR est anormal dans environ un tiers des cas chez l’adulte avec présence d’une hyperprotéinorachie, d’une hypercellularité modérée composée de lymphocytes ou de polynucléaires neutrophiles, rarement d’une hypoglycorachie. L’imagerie cérébrale par résonance magnétique nucléaire (IRM) est plus sensible que la tomodensitomérie, mais n’est pas toujours anormale ; elle peut montrer une atrophie cérébrale, des hypersignaux de la substance banche. L’atteinte pulmonaire Sa fréquence varie de 5 à 77 % des cas selon les séries. Elle peut être spécifique, comportant alors essentiellement un épanchement pleural et une pneumopathie interstitielle (figures 4 et 5), mais doit faire évoquer en premier lieu une pneumopathie infectieuse(9) . Figures 4 et 5. Hémorragie intra-alvéolaire révélatrice d’un LED chez une adolescente. Les lésions cardiovasculaires L’atteinte cardiaque se signale surtout par une péricardite, parfois compliquée de tamponade, et plus rarement par une myocardite ; une atteinte valvulaire ou une atteinte des artères coronaires secondaire à des lésions de coronarite et/ou d’athérosclérose sont également décrites(10). La survenue de thromboses, parfois révélatrice du LED, est rapportée chez 9 à 17 % des enfants, associée essentiellement à la présence d’un anticoagulant de type lupique, et à la présence d’un anticorps anti-cardiolipine dans certaines études(11). Symptomatologie abdominale La série française(5) met en évidence la fréquence de l’atteinte digestive initiale présente chez 16 % des patients, notamment des pancréatites ; la symptomatologie est parfois trompeuse, et la présence de douleurs abdominales fébriles isolées a conduit à effectuer une appendicectomie chez trois adolescentes, avant que le diagnostic de LED ne soit porté. Une hépatomégalie, secondaire à une stéatose et/ou une hépatite non spécifique, des adénopathies et une splénomégalie peuvent être présentes. Autres La survenue d’un syndrome sec est peu fréquente chez l’enfant ; une atteinte parotidienne, une adénite peuvent révéler un LED. La présence d’anticorps anti-thyroglobuline est fréquente, mais est rarement associée à un dysfonctionnement thyroïdien. Les signes généraux, tels qu’une hyperthermie, une asthénie ou une perte de poids sont inconstants, présents à la période initiale chez 40 à 74 % des enfants. Signes biologiques aidant au diagnostic Le syndrome inflammatoire Au cours des poussées, la vitesse de sédimentation (VS) est constamment élevée, la protéine C-réactive est peu ou pas augmentée (< 50 mg/l), sauf en cas d’atteinte des séreuses, où l’élévation peut être importante, et en cas d’infection. Il existe fréquemment une anémie inflammatoire modérée et une hypergammaglobulinémie ; l’élévation des alpha-2 globulines est plus inconstante. Lors de rémission clinique, la VS peut se normaliser ou rester élevée, et n’a donc pas de valeur pronostique. Les facteurs antinucléaires (FAN) Ils sont présents chez plus de 94 à 100 % des enfants porteurs de LED, mais ont une mauvaise spécificité, et sont retrouvés dans 5 % de la population générale. La spécificité de ce test augmente avec l’augmentation des taux, de 35 % pour un taux faible de 1/20° à plus de 95 % pour des taux > 1/1 280° respectivement. Le seuil de 1/160° permet d’avoir le meilleur rapport entre spécificité et sensibilité(12). La persistance de FAN à taux élevé peut s’observer au cours de rémission clinique prolongée. l Les différents aspects de fluorescence L’aspect homogène, lié à la présence d’anticorps anti-histones et d’anticorps dirigés contre des nucléoprotéines insolubles, est le plus souvent observé au cours du LED. La fluorescence périphérique traduit la présence d’anticorps anti-ADN. La fluorescence mouchetée correspond aux anticorps dirigés contre les antigènes nucléaires solubles (anticorps anti-Ssa, SSb, Sm, RNP). La fluorescence nucléolaire, reconnaissant une riboprotéine nucléaire, est toujours associée à une fluorescence d’un autre type dans le LED. Les anticorps anti-ADN natif sont la clé du diagnostic La présence d’anticorps anti-ADN natif est observée dans 95 % des cas de LED. Les anticorps anti-ADN sont également retrouvés dans d’autres maladies systémiques (arthrite juvénile idiopathique, dermatomyosite, connectivite mixte, sclérodermie systémique). Ils peuvent être dosés par trois méthodes principales, dont les résultats sont parfois discordants. > Le test de Farr est la méthode de référence, mais est effectué dans peu de laboratoires. Il détecte les anticorps de forte affinité et a une très bonne spécificité. Il peut se négativer alors que le test ELISA reste positif. Sa forte positivité est associée statistiquement à l’existence d’une néphropathie proliférative. > Les tests ELISA sont très sensibles, mais leur positivité sous traitement n’est pas synonyme d’évolutivité de la maladie. Il s’agit donc d’une bonne méthode de dépistage, mais de peu de valeur dans le suivi. > Le test d’immunofluorescence indirecte de Crithidia luciliae est une méthode sensible de dépistage. Les anticorps spécifiques d’antigènes nucléaires Ces anticorps sont dirigés contre des protéines non basiques et solubles dans des tampons salins. On distingue principalement : – les anticorps anti-Sm, peu sensibles mais très spécifiques du LED, qui se rencontrent dans 11 à 45 % des LED pédiatriques ; – les anticorps anti-Ssa (14 à 40 % des cas), SSb et RNP (11 à 47 % des cas), qui se rencontrent dans d’autres connectivites. L’hypocomplémentémie Une diminution des fractions C3 ou du C4 du complément est présente chez 65 à 91 % des enfants. L’association d’une hypocomplémentémie et d’un titre élevé d’anticorps anti-DNA natif a une valeur prédictive positive de 100 % pour le diagnostic de LED. Prise en charge Il n’existe aucun essai randomisé pédiatrique concernant le traitement du LED. Les recommandations sont issues d’études rétrospectives et non contrôlées ou, surtout, extrapolées du traitement de LED de l’adulte. Le traitement doit être discuté au cas par cas avec une équipe spécialisée. Une information claire et répétée Des explications répétées à l’adolescent(e) et aux parents sont indispensables pour la prise en charge de cette maladie chronique, sévère, d’évolution imprévisible, au cours de laquelle d’importants problèmes de compliance se rencontrent presque constamment lorsqu’une corticothérapie prolongée est nécessaire. La nécessité d’un suivi régulier prolongé doit également faire l’objet d’explications réitérées, y compris quand le LED est quiescent, car des rechutes sévères peuvent survenir après des années d’évolution. AINS et hydroxychloroquine Les traitements généraux sont très variables en fonction du ou des organe(s) atteints(13). Le traitement des formes mineures avec atteinte cutanée et/ou articulaire repose sur l’aspirine à forte dose et les anti-inflammatoires non stéroïdiens ou l’hydroxychloroquine (Plaquenil®) (atteinte cutanée, notamment le lupus discoïde, manifestations articulaires et signes généraux non contrôlés par les AINS). Corticoïdes Les corticoïdes sont généralement nécessaires chez l’enfant, mais ils ne doivent être utilisés qu’après échec des AINS et du Plaquenil® dans les formes bénignes, ou d’emblée dans les formes graves. L’association à un régime hyposodé hypocalorique est essentielle pour tenter de prévenir la prise de poids majeure fréquemment observée chez les adolescentes, source de non compliance, et devra être longuement expliquée par une diététicienne. Immunosuppresseurs et anticorps monoclonaux L’association de la corticothérapie à des immunosuppresseurs est proposée : Endoxan®, Azathioprine®, Méthotrexate® et, plus récemment, mycophénolate mofétyl (Cellcept®), inhibiteur réversible de l’inosine monophosphate déshydrogénase inhibant sélectivement l’activité des lymphocytes. De nouveaux traitements reposant sur l’utilisation d’anticorps monoclonaux anti-CD20 sont en cours d’évaluation(14,15). La contraception Le problème de la contraception doit être systématiquement abordé avec les adolescentes. Les estroprogestatifs sont contre-indiqués du fait, d’une part, des risques de poussée lupique imputable aux estrogènes et, d’autre part, de l’induction d’anomalies lipidiques et des facteurs de l’hémostase augmentant le risque d’athérome et de thrombose. Un progestatif pur tel que le Lutéran® peut être proposé. Modalités d’évolution Le LED évolue par poussées susceptibles de laisser des séquelles variables selon les organes intéressés. Schématiquement, on distingue les formes cutanéo-articulaires bénignes et les formes viscérales sévères (rein, système nerveux central), mais il existe des passages d’une forme à l’autre. Trois modalités évolutives peuvent être en pratique distinguées : – la persistance d’une maladie chronique active qui semble la plus fréquente ; – une alternance de poussées du LED et de rémission ; – une quiescence prolongée de la maladie (plus rarement). L’index d’activité SLEDAI (systemic lupus erythematosus disease activity index) et l’index de chronicité lésionnelle SLICC (systemic lupus erythematosus international collaborating clinics), prenant en compte les principales localisations de la maladie, très utilisés chez l’adulte, ont été validés chez l’enfant(16). Une morbidité toujours élevée Les traitements actuels ont permis une diminution considérable de la mortalité, qui est cependant encore de 15 à 20 % dans les quelques séries pédiatriques sur ce sujet(17-18). La cause principale de mortalité est représentée par les complications infectieuses, remplaçant l’insuffisance rénale chronique. La survenue d’athérosclérose précoce chez l’adulte jeune, secondaire à la corticothérapie, mais également aux anomalies lipidiques présentes dans la maladie lupique est responsable de décès tardifs, et incite à une surveillance cardiovasculaire attentive prolongée. Cependant, la morbidité reste élevée, liée à la maladie elle-même, mais surtout aux effets secondaires des traitements, et particulièrement à la corticothérapie. Dans une cohorte de 104 patients suivis pendant au moins 18 ans, seuls 11 % des patients « allaient bien », sans signes lupiques ni poussées durant les 5 dernières années, sans ou avec séquelles minimes(19). Perspectives Des études prospectives multicentriques sont nécessaires afin de mieux connaître l’évolution à long terme et de proposer des essais thérapeutiques pédiatriques. C’est pour répondre à ces objectifs, qu’un registre français d’étude du LED à début pédiatrique vient de se constituer.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :